Wojciech Kamysz
Gdański Uniwersytet Medyczny
strony wersji drukowanej: 32-36

strony wersji drukowanej: 32-36

Wprowadzenie nowego produktu leczniczego do obrotu to wyjątkowo długi i kosztowny proces. Nie wydaje się to być jednak niczym dziwnym i szczególnym w odniesieniu do funkcji i działania jakie pełnią one dla organizmu człowieka. Etap badawczo-rozwojowy nowego leku obejmuje wiele kroków i badań. Jednymi z nich są badania stabilności, będące podstawą określenia daty ważności leku i udowodnienia, że w całym swoim okresie trwałości lek pozostaje skuteczny i bezpieczny dla pacjenta. Badania stabilności nowego leku opierają się w pierwszym etapie na sprawdzeniu i poznaniu trwałości substancji aktywnej (API) w fazie stałej i/lub w roztworach, a w następnej kolejności na poznaniu trwałości gotowej postaci tego leku. Każdy układ fizykochemiczny podlega bowiem ciągłym zmianom. Zmiany w produkcie leczniczym mogą być wynikiem:
2. oddziaływania między:
- substancjami pomocniczymi
- substancją czynną i pomocniczymi substancją czynną i materiałem opakowania
- substancjami pomocniczymi i materiałem opakowania
- substancją czynną, substancjami pomocniczymi i materiałami opakowania.
Na rodzaj zachodzących zmian i przemian mają wpływ czynniki zależne od produkcji (np. wielkość serii, wyposażenie, kolejność dodawania składników przy formowaniu postaci leku czy jakość substancji aktywnej, substancji pomocniczych i materiałów opakowaniowych) oraz czynniki zewnętrzne (np. temperatura, wilgotność, światło, pH roztworu).
Typowe badanie stabilności leku zależy więc od charakteru przemian jakim może dany lek ulegać. Do najczęstszych zmian należą:
1. przemiany chemiczne (np.: hydroliza, utlenianie, redukcja, hydratacja, polimeryzacja),
2. zjawiska fizyczne (zmiana konsystencji, powstawanie osadów, sedymentacja zawiesin, rozpad emulsji),
3. zmiany biologiczne (utrata aseptyczności).
Celem testów trwałości jest więc ustalenie mechanizmów zachodzących reakcji i przemian, określenie ich szybkości oraz ewentualne ustabilizowanie układu, tak aby możliwe było określenie warunków przechowywania leku oraz terminu ważności preparatu.
ELEMENTY BADAŃ STABILNOŚCI
Zasady przeprowadzania badań stabilności leków są ściśle określone przez międzynarodowe wytyczne ICH: „Stability” Q1A-Q1F. Regulują one zasady testów trwałości w zakresie:
- wyboru i ilości serii
- materiałów opakowaniowych
- kryteriów akceptacji
- warunków przechowywania
- częstotliwości badań
- metod analitycznych
- oznakowania
Wybór i ilość serii do badań stabilności
Badania stabilności należy wykonać przynajmniej dla 3 serii produktu leczniczego o składzie i w opakowaniu przewidzianym do sprzedaży. Proces wytwarzania tych 3 serii powinien odpowiadać planowanemu procesowi produkcji serii rynkowych, a jakość wytworzonych partii powinna być zgodna z jakością serii planowanych do wprowadzenia do obrotu. Dwie z trzech badanych serii powinny być wyprodukowane w sakli pilotażowej, trzecia może być w mniejszej ilości. Jeśli to możliwe, wskazanym byłoby też, aby serie produktu do badań stabilności wytworzone zostały z różnych partii substancji aktywnej (API).
Badania stabilności powinny być przeprowadzone w planowanych opakowaniach handlowych, włącznie z opakowaniami zewnętrznymi i etykietami.
Kryteria akceptacji
W ocenie trwałości leku należy uwzględnić takie badania, które wykazują potencjalną podatność na zmiany podczas przechowywania, a które są szczególnie ważne dla jakości, bezpieczeństwa i skuteczności tego leku.
Testy trwałości powinny uwzględniać np.:
- ocenę organoleptyczną,
- właściwości fizykochemiczne,
- właściwości chemiczne – zawartość i czystość substancji czynnej, konserwantów,
- czystość mikrobiologiczną.
Testy trwałości powinny uwzględniać np.:
- ocenę organoleptyczną
- właściwości fizykochemiczne
- właściwości chemiczne – zawartość i czystość substancji czynnej, konserwantów
- czystość mikrobiologiczną.
Warunki przechowywania
Badania stabilności produktów leczniczych, ze względu na warunki temperatury i wilgotności w których są prowadzone dzieli się na 3 rodzaje:
1. badania długoterminowe – prowadzone przez cały deklarowany dla danego leku okres trwałości, w zalecanych na etykiecie warunkach przechowywania.
2. badania przyspieszone – testy zaprojektowane w celu przyspieszenia procesów chemicznego rozkładu rozkładu oraz przemian fizycznych leku pod wpływem zaostrzonych warunków temperatury i wilgotności; wyniki tych badań pozwalają np. przewidzieć stabilność leku podczas krótkotrwałych odchyleń od deklarowanych warunków przechowywania, jakie mogą wystąpić np. podczas transportu.
3. badania pośrednie – prowadzone w temp. 30°C i wilgotności 65% RH, zaprojektowane w celu średniego przyspieszenia chemicznego rozkładu i przemian fizycznych leku przechowywanego długoterminowo w temp. 25°C.
Warunki przechowywania próbek do badań stabilności powinny odzwierciedlać warunki przechowywania tego leku w całym jego okresie ważności, tak aby sprawdzić jego stabilność temperaturową, wrażliwość na wilgoć oraz potencjalną utratę wody. Dla produktów leczniczych planowanych do przechowywania w temperaturze pokojowej wykonuje się badania stabilności zgodnie z ogólnymi wytycznymi przedstawionymi w Tab. 1.
Tab. 1. Badania stabilności leków przechowywanych w temperaturze pokojowej.
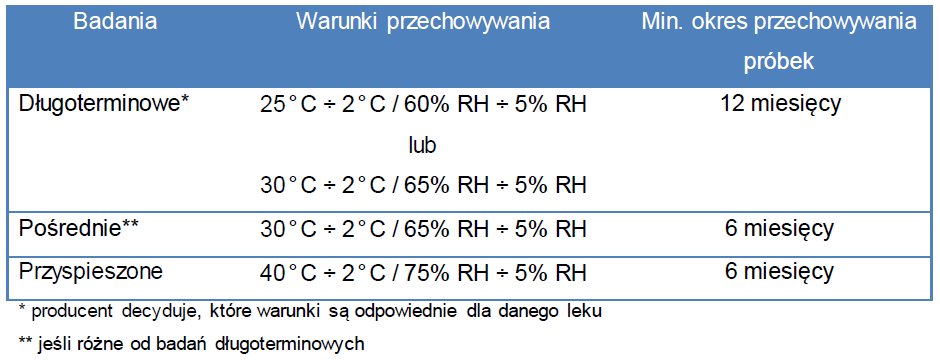
Jeżeli wyniki badań przyspieszonych wykazują „znaczne zmiany” w jakości produktu należy wykonać badania pośrednie w temp. 30°C. „Znaczne zmiany” podczas badań stabilności oznaczają np.:
1. 5% zmianę zawartości substancji
2. przekroczenie kryteriów akceptacji dla produktów degradacji
3. niezgodność z kryteriami akceptacji dla wyglądu, właściwości fizycznych i testów funkcjonalności (np. barwa, podział faz, twardość itp.)
4. przekroczone limity pH.
Dla produktów niestabilnych w temperaturze pokojowej, dla których planowane jest przechowywanie w obniżonej temperaturze, badania stabilności prowadzi się w warunkach określonych w Tab. 2 i Tab. 3.
Tab. 2. Badania stabilności leków przechowywanych w lodówce.
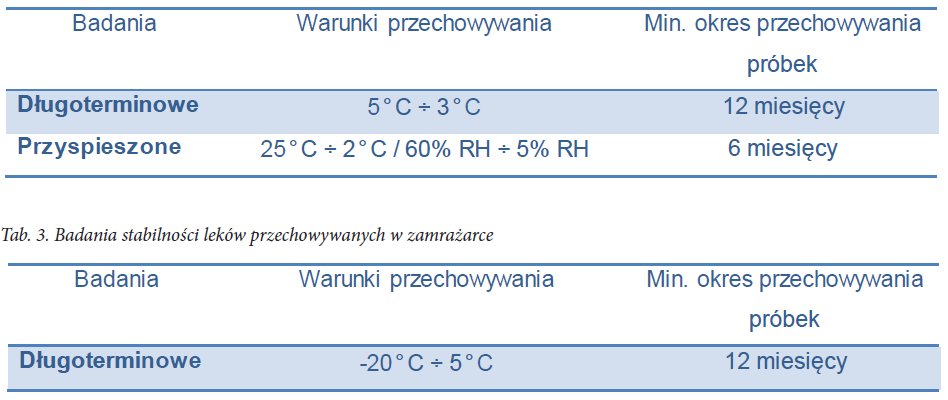
Jeżeli w przyspieszonych badaniach stabilności, pomiędzy 3 a 6 miesiącem badań, wystąpią znaczące zmiany, okres ważności leku należy określić na podstawie wyników badań długoterminowych. Jeśli zmiany pojawią się już w pierwszych 3 miesiącach, nie ma potrzeby kontynuowania badań przez kolejne 3 miesiące; wskazane jest natomiast włączenie do badań nowej partii produktu i jej badanie przez okres krótszy niż 3 miesiące, ale z większą częstotliwością.
Dla produktów wymagających przechowywania w zamrażarce okres trwałości należy wyznaczyć na podstawie rzeczywistych danych otrzymanych z badań długoterminowych.
Jeśli opracowywany nowy produkt leczniczy wymagałby przechowywania w temperaturze poniżej -20°C, badania stabilności i okres ważności leku należy zaplanować i określić indywidualnie dla danego przypadku.
Częstotliwość badań
Badania długoterminowe
- co 3 miesiące w pierwszym roku badań
- co 6 miesięcy w drugim roku badań
- co 12 miesięcy od trzeciego roku badań
Badania przyspieszone
- min. 3 punkty czasowe (np. 0,3 i 6 m-cy), uwzględniając badanie początkowe i końcowe z 6-o miesięcznego okresu trwania badania.
Badanie pośrednie
- min. 4 punkty czasowe (np. 0,6,9,12 m-cy), uwzględniając badanie początkowe i końcowe z zalecanego 12-miesięcznego okresu badań.
Metody analityczne
Metody analityczne wykorzystane w analizie próbek i badań stabilności muszą być odpowiednie do każdego testowanego parametru. Muszą dawać gwarancję, że każda zmiana jakościowa która może mieć miejsce w trakcie programu badań, będzie wykrywalna w możliwie najwcześniejszym stadium i na poziomie statystycznie istotnym. Zastosowane metody analityczne muszą być zwalidowane, zgodnie z wytycznymi ICH, a sprzęt wykorzystywany do oznaczeń musi być kwalifikowany i odpowiednio nadzorowany.
Oznakowanie
Na podstawie wyników badań testów stabilności powinny zostać opracowane stosowne informacje do umieszczenia na opakowaniu produktu leczniczego. Powinny to być przede wszystkim dane o deklarowanej dacia ważności leku oraz warunkach jego przechowywania.
APARATURA
Badania stabilności leków muszą być prowadzone w ściśle określonych warunkach, z dużą dokładnością co do utrzymywanej temperatury i wilgotności. W testach stabilności wykorzystywane są specjalne komory stabilności lub nawet w całości dedykowane pomieszczenia z całodobowym monitoringiem parametrów. Dopuszcza się tylko krótkoterminowe odchylenia od zadanych limitów temperatury i wilgotności, np. powstałe podczas otwierania drzwi. Odstępstwa dłuższe niż 24 godz. powinny być wytłumaczone i zbadane pod kątem ich wpływu na wynik całego programu badań stabilności.







