Maciej Jaśkiewicz
Gdański Uniwersytet Medyczny
strony wersji drukowanej: 35-41
Białka odgrywają jedną z najważniejszych ról we wszystkich procesach biologicznych, pełniąc istotne funkcje zarówno u organizmów jednokomórkowych jak i wysoce zorganizowanych układów u zwierząt. Odpowiadają one między innymi za transport i magazynowanie substancji odżywczych, wzrost i różnicowanie, przemiany wewnątrzkomórkowe, a także ochronę immunologiczną. Różnorodność funkcjonalna białek determinowana jest mnogością struktur przestrzennych jakie mogą one przyjmować (funkcja białek jest następstwem ich struktury). Z chemicznego punktu widzenia białka to złożone makrocząsteczkowe polimery zbudowane z aminokwasów połączonych kowalencyjnie wiązaniami peptydowymi. Każda cząsteczka białka ma dokładnie zdefiniowaną ilość podstawowych jednostek strukturalnych, aminokwasów, a także dokładnie określoną ich liniową kolejność. Co więcej, duża część białek w konsekwencji modyfikacji potranslacyjnych może nabyć nowych cech strukturalnych oraz funkcjonalnych.
strony wersji drukowanej: 35-41

Białka odgrywają jedną z najważniejszych ról we wszystkich procesach biologicznych, pełniąc istotne funkcje zarówno u organizmów jednokomórkowych jak i wysoce zorganizowanych układów u zwierząt. Odpowiadają one między innymi za transport i magazynowanie substancji odżywczych, wzrost i różnicowanie, przemiany wewnątrzkomórkowe, a także ochronę immunologiczną. Różnorodność funkcjonalna białek determinowana jest mnogością struktur przestrzennych jakie mogą one przyjmować (funkcja białek jest następstwem ich struktury). Z chemicznego punktu widzenia białka to złożone makrocząsteczkowe polimery zbudowane z aminokwasów połączonych kowalencyjnie wiązaniami peptydowymi. Każda cząsteczka białka ma dokładnie zdefiniowaną ilość podstawowych jednostek strukturalnych, aminokwasów, a także dokładnie określoną ich liniową kolejność. Co więcej, duża część białek w konsekwencji modyfikacji potranslacyjnych może nabyć nowych cech strukturalnych oraz funkcjonalnych.

Większość białek w organizmie ludzkim to białka wewnątrzkomórkowe, a poziom ich ekspresji jest zróżnicowany w zależności od komórek/tkanek, w których występują. Następnie wydzielane są do osocza i płynu śródmiąższowego, gdzie zaczynają pełnić swoją funkcję (do 95% ogólnej liczby białek osocza ma pierwotną lokalizację wewnątrz-komórkową). Pula białek krążących może się zmieniać wraz z wiekiem, a także w różnych stanach fizjologicznych i patologicznych. W związku z powyższym w wielu przypadkach stanowią one doskonały laboratoryjny wskaźnik stanu zdrowia, co może pozwolić na wczesne wdrożenie odpowiedniego leczenia.
Podział białek
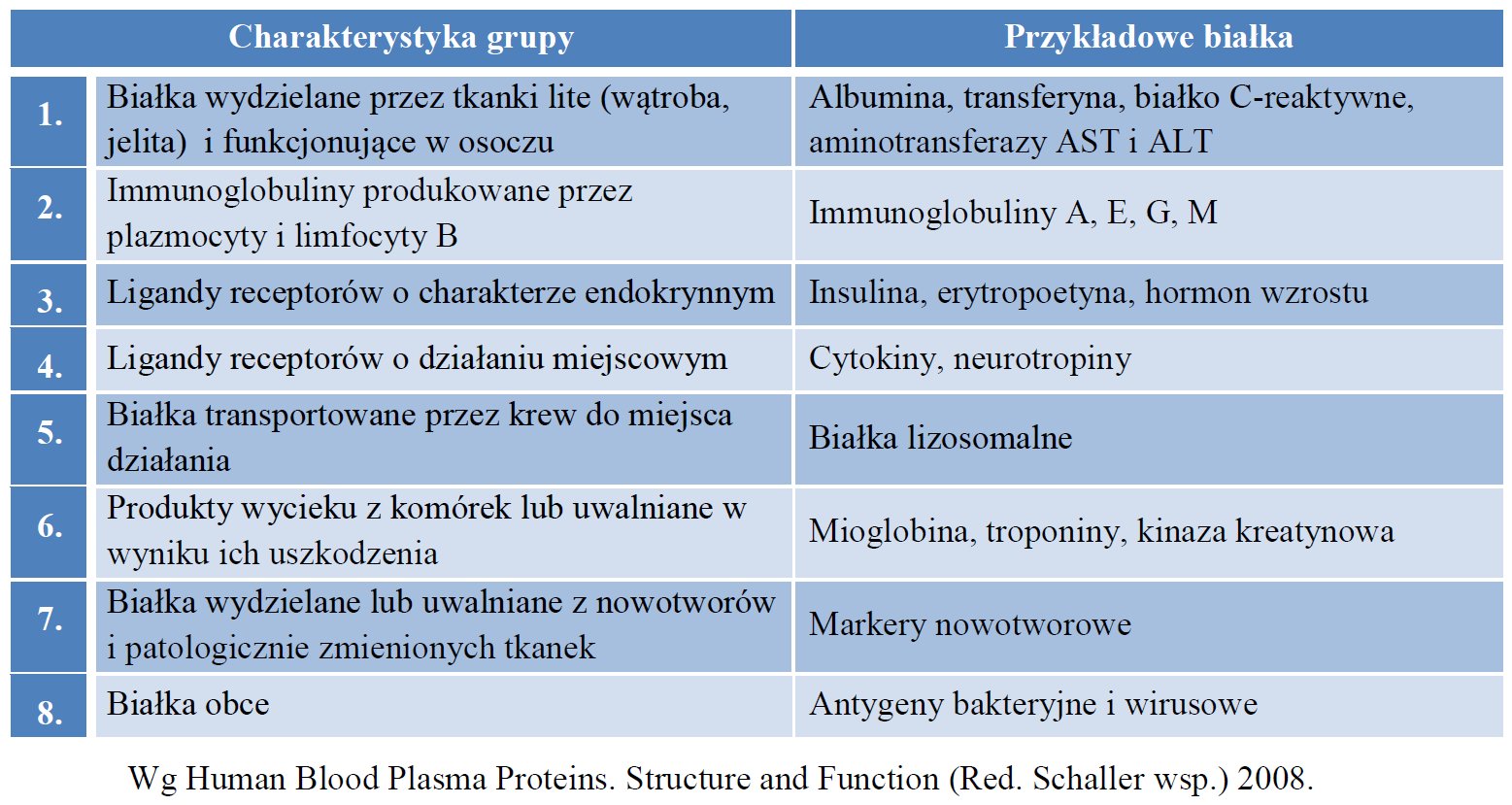
Osocze jest płynem, które pozostaje w kontakcie z komórkami wszystkich tkanek organizmu. Stanowi ono płynne środowisko krwi pełniąc funkcje transportowe oraz komunikacyjne. Przenosi ono do tkanek substancje niezbędne do życia komórek jednocześnie usuwając z przestrzeni śródtkankowej końcowe produkty metabolizmu. W osoczu ludzkim istnieje około 700 białek. Każde z nich posiada kilka mas cząsteczkowych, co wynika zarówno z koegzystencji form prekursorowych, dojrzałych, degradowanych czy też wariantów modyfikacji potranslacyjnych. Sumarycznie daje to kilkadziesiąt tysięcy form molekularnych klasycznych białek osocza. Stosunkowo niewielka ilość tych białek jest oznaczana zarówno do celów podstawowej jak i wysoce wyspecjalizowanej diagnostyki laboratoryjnej. Białka, ze względu na miejsce syntezy oraz funkcję, można podzielić na szereg grup (tab. 1).
Funkcje białek osocza
Białka występujące w osoczu wykazują znaczną różnorodność pod względem liczebności i pełnionej funkcji. Odpowiadają one między innymi za:
1. Ciśnienie onkotyczne – jest to rodzaj ciśnienia osmotycznego, utrzymywanego przez białka obecne w krwi (głównie albuminy). Ciśnienie to równoważy ciśnienie hydrostatyczne krwi w naczyniach krwionośnych (wynoszące ok. 30 mmHg). Pozwala to na utrzymanie odpowiedniej objętości osocza w krwioobiegu. W sytuacjach patologicznych, w których następuje znaczne obniżenie poziomu białek osocza (białkomocz, niedożywienie) dochodzi do obniżenia ciśnienia onkotycznego, co prowadzić może do powstania obrzęku.
 2. Funkcje transportowe - głównym białkiem transportowym osocza jest albumina. Dzięki zawartości aminokwasów dwukarboksylowych oraz wysokiemu stężeniu stanowi układ o dużej pojemności wiążącej. Pozostałe białka transportowe, których stężenie jest co najmniej dziesięciokrotnie niższe od albuminy, pełnią funkcję transporterów specyficznych. Wykazują one powinowactwo do ściśle określonych substancji biologicznie czynnych. Co więcej, również niektóre hormony posiadają swoje białka transportowe.
2. Funkcje transportowe - głównym białkiem transportowym osocza jest albumina. Dzięki zawartości aminokwasów dwukarboksylowych oraz wysokiemu stężeniu stanowi układ o dużej pojemności wiążącej. Pozostałe białka transportowe, których stężenie jest co najmniej dziesięciokrotnie niższe od albuminy, pełnią funkcję transporterów specyficznych. Wykazują one powinowactwo do ściśle określonych substancji biologicznie czynnych. Co więcej, również niektóre hormony posiadają swoje białka transportowe.3. Aktywność regulatorowa lub enzymatyczna – jedną z ważniejszych ról białek stanowi ich zdolność do katalizy specyficznych reakcji chemicznych zachodzących w organizmie. Pośród nich możemy wymienić enzymy będące zarówno inhibitorami jak i aktywatorami w układzie krzepnięcia, w metabolizmie lipoprotein/lipidów, oksydoreduktazy jak np. ceruloplazmina katalizująca utlenienie Fe2+ do Fe3+ (umożliwiając wiązanie z transferyną). Ponadto wymienić można też proteazy takie jak renina i konwertaza angiotensyny powodujące odczepienie mało aktywnego dekapeptydu – angiotensyny I od angiotensynogenu, a następnie jej proteolityczną konwersję do aktywnej biologicznie angiotensyny II (oktapeptyd, będący jednym z najbardziej efektywnych regulatorów ciśnienia krwi). W praktyce klinicznej duże znaczenie odgrywają enzymy pierwotnie wewnątrzkomórkowe, takie jak aminotransferazy alaninowa (ALAT) i aspraginowa (AspAT), kinaza kreatynowa, fosfataza kwaśna i zasadowa czy też elastaza 3B. Aktywność oraz ilość tych enzymów wzrasta wskutek uwalniania z uszkodzonych/obumierających lub zmienionych zapalnie komórek.
4. Układ odpornościowy – niezwykle istotną rolą białek jest ich udział w reakcjach odpornościowych organizmu. Duża część stanowiąca układ dopełniacza posiada zdolność do tworzenia cząstek atakujących błony (element odporności nieswoistej). Natomiast aktywne limfocyty B posiadają zdolność wytwarzania różnych klas przeciwciał (immunoglobulin). Komórki te pod wpływem różnych antygenów tworzą odrębne linie (klony) komórkowe, z których każda produkuje specyficzne przeciwciało. U dorosłego człowieka istnieje kilkadziesiąt tysięcy specyficznych przeciwciał powstających na skutek ekspozycji na różne egzogenne antygeny. W tym wypadku mówimy o odporności swoistej.
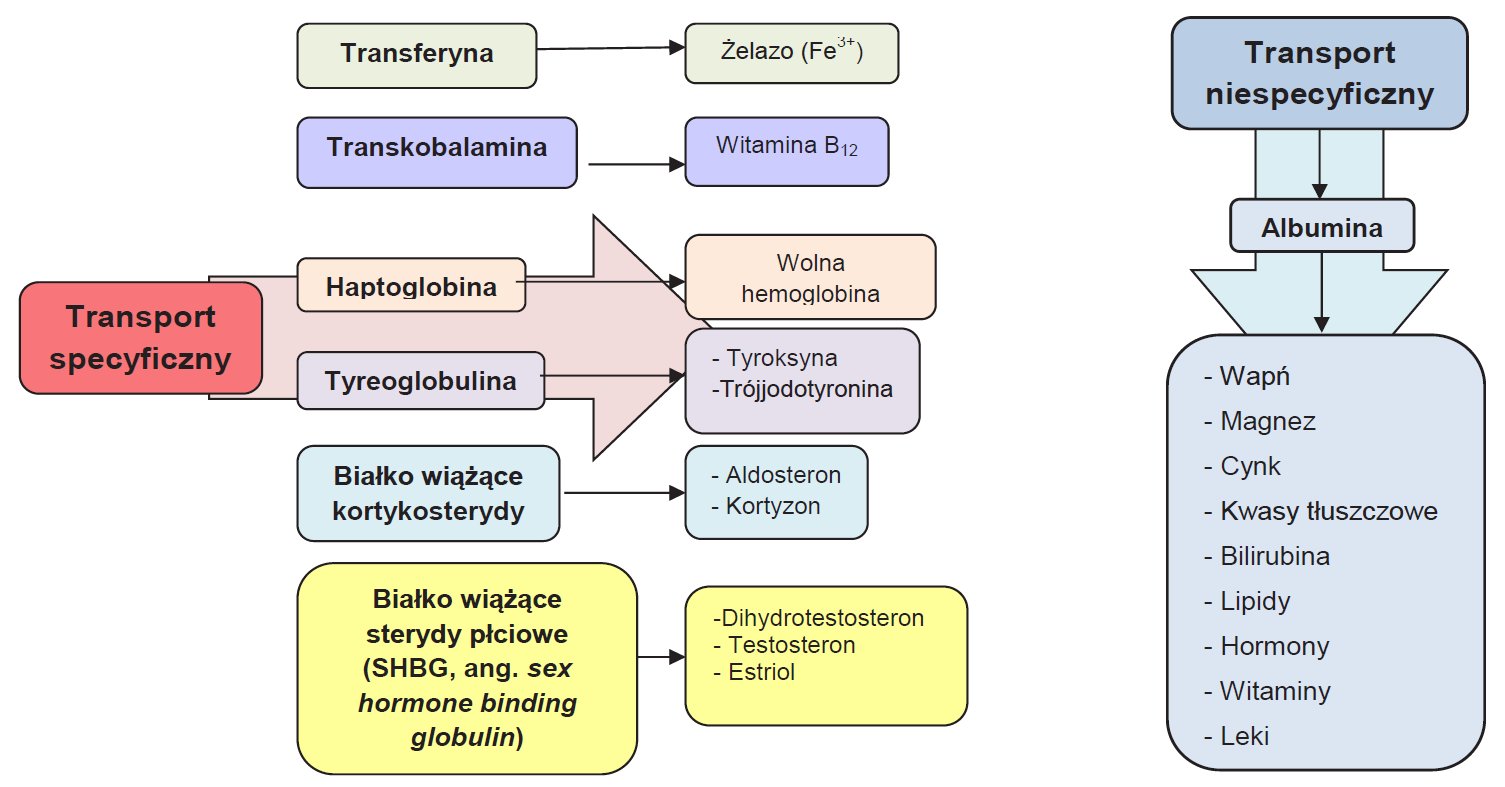
Ryc.1. Białka transportowe osocza.
Diagnostyka laboratoryjna i metody oznaczania białka
Ilość białek w osoczu, ze względu na rolę jaką odgrywają, niejednokrotnie odzwierciedla zaburzenia funkcji narządów uczestniczących w utrzymaniu homeostazy organizmu. Nieprawidłowa czynność wątroby, nerek, układu odpornościowego, choroby nowotworowe a nawet niedożywienie objawiają się zmianami stężenia białek, tym samym oznaczenie ich ilości stanowi doskonałe narzędzie w diagnostyce klinicznej.

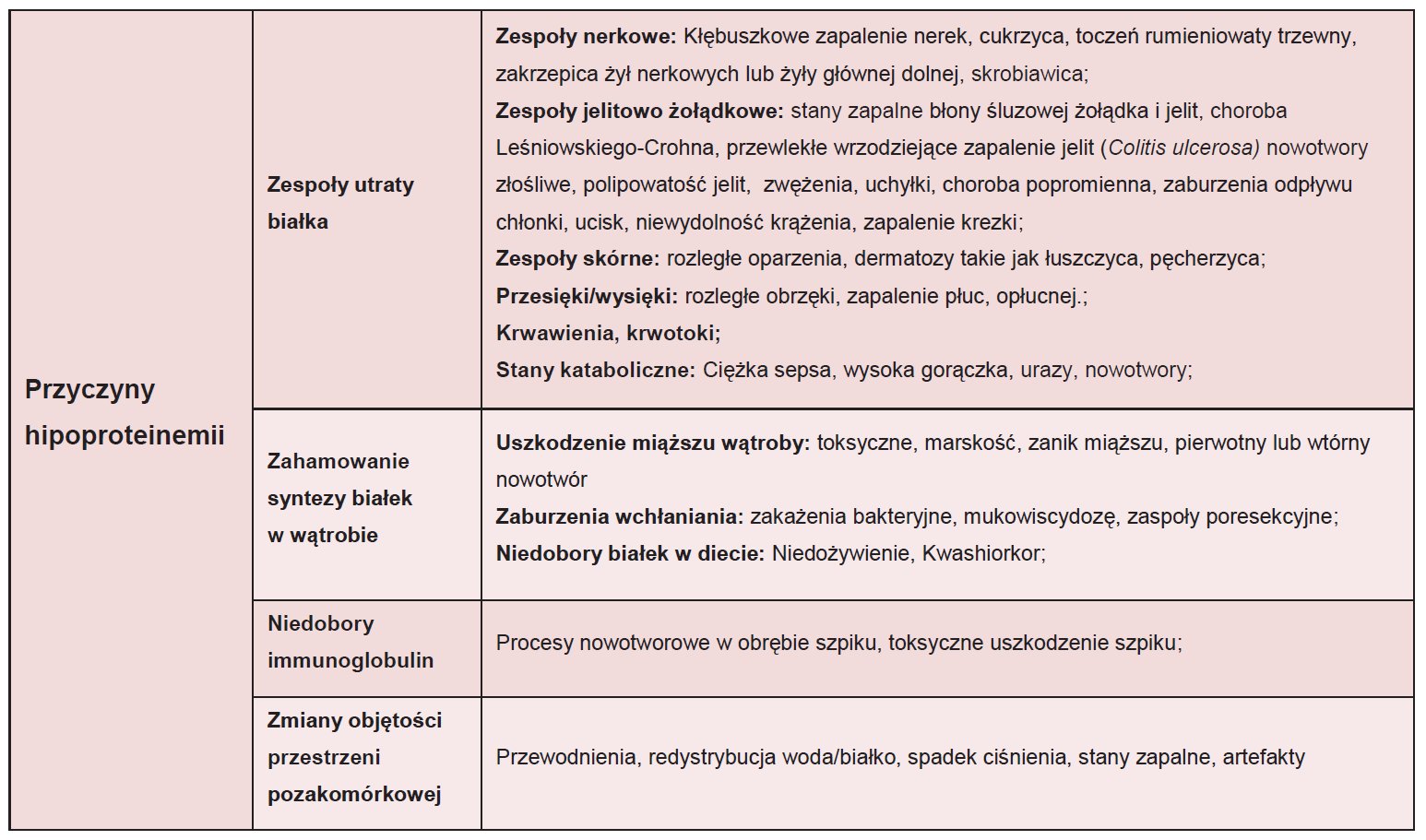
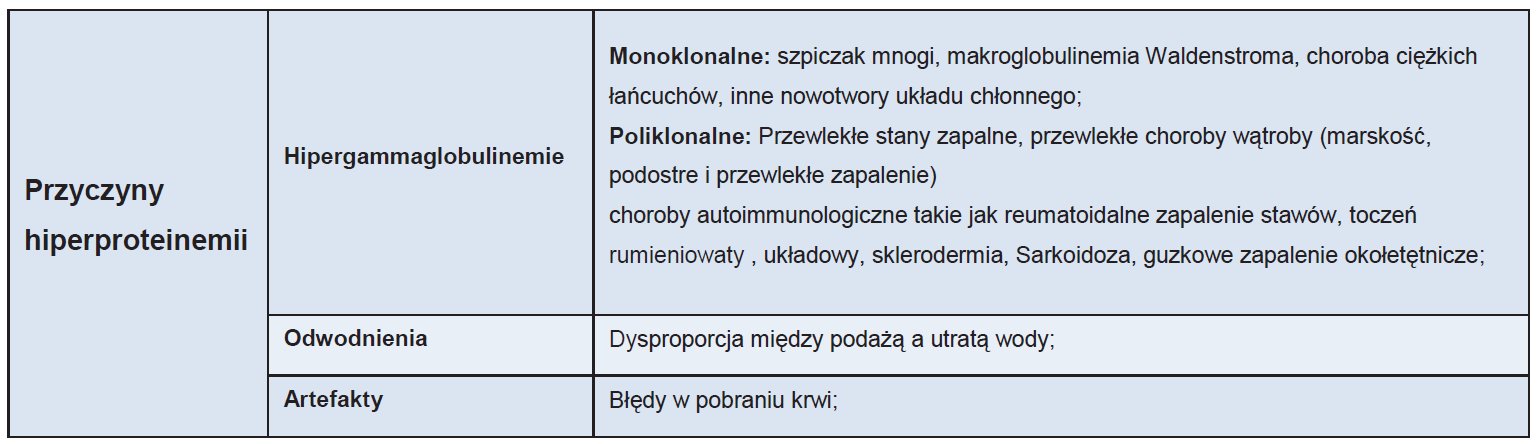
Obniżone stężenie białka (hipoproteinemia) występuje znacznie częściej niż jego wzrost i na ogół jest wynikiem hipoalbuminemii. Stan ten dotyczy pacjentów dotkniętych zespołem nerczycowym, bądź też chorych ze schyłkową marskością wątroby. Do przyczyn hiperproteinemii należą przede wszystkim: odwodnienie, obecność przeciwciał monoklonalnych i poliklonalnych, a także przewlekły stan zapalny. Postawienie prawidłowej diagnozy, tym samym wdrożenie stosownego leczenia związane jest z uzyskaniem wiarygodnych wyników. Niejednokrotnie decydujące w tym wypadku jest wdrażanie odpowiednich procedur związanych z pobraniem próbek, a także przygotowaniem pacjenta. Na stężenie białka wpływają między innymi warunki pobrania krwi. Pionizacja ciała powoduje jej zagęszczenie o ok. 10%, wysiłek fizyczny może skutkować wzrostem stężenia białka o kolejne 10% (w przypadku AspAT i ALAT nawet do 40%), natomiast u pacjenta leżącego (w wyniku rozcieńczenia krwi) możemy mówić o stężeniu o 7-15% niższym. Należy mieć również na uwadze wpływ błędów trywialnych takich jak zbyt długi ucisk stazy (powodujący ucieczkę wody do tkanek i zagęszczenie pobranej do badań krwi). By wyeliminować wpływ warunków zewnętrznych (w szczególności u pacjentów ambulatoryjnych) należy przed pobraniem krwi stosować około półgodzinny odpoczynek w pozycji siedzącej.
Białko osocza stanowi niejednorodną mieszaninę białek funkcjonalnych, charakteryzujących się różną budową i właściwościami. W związku z powyższym, ocena ilościowa białka całkowitego osocza stanowi nie lada problem, ponieważ nie ma układu odniesienia do oceny tego rodzaju mieszaniny niejednorodnej. W klasycznej analizie biochemicznej podstawą do oceny białka jest ilość azotu związanego w jego masie. Jako wzorzec przyjmuje się cząsteczki albuminy wołowej po precypitacji kwasem trójchlorocotowym (TCA). W tym wypadku, azot związany z białkiem można przeliczyć na masę białka (g) mnożąc przez współczynnik 6,25.
Tab. 3. Najczęstsze przyczyny hipoproteinemii .
Tab. 4. Najczęstsze przyczyny hiperproteinemii.
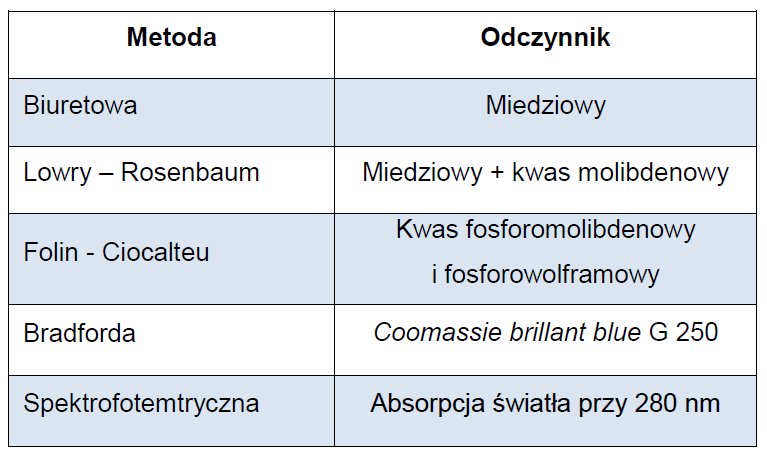
Referencyjną metodą oznaczania azotu białkowego jest metoda wolumetryczna Kjeldahla. Obecnie stosuje się metody kolorymetryczne. Pierwszą z nich jest metoda biuretowa. Wiązania peptydowe obecne w białkach reagują z jonami Cu2+ w roztworze alkalicznym dając barwny produkt, którego absorbancję mierzy się spektrofotometrycznie (długość fali 546 nm). Intensywność powstałego zabarwienia jest wprost proporcjonalna do ilości wiązań peptydowych. W metodzie tej, z zastosowanym odczynnikiem nie reagują zarówno aminokwasy jak i peptydy. Tripeptydy, oligopeptydy i polipeptydy natomiast reagują dając zabarwienie od różowego do fioletowego. Na podobnej zasadzie tworzenia barwnych kompleksów z atomami azotu wiązań peptydowych i różnymi resztami aminokwasowymi oparte zostały inne metody kolorymetryczne (Tabela 5). W metodach Lowry’ego – Rosenbaum czy też Folina–Ciocalteu wykorzystany został fakt redukcji kwasów fosforomolibdenowego i fosforowolframowego przez zawarte w białkach aminokwasy aromatyczne: tyrozynę i tryptofan. Obie reakcje przebiegają również w środowisku zasadowym, a intensywność powstałego zabarwienia zależy od rodzaju oznaczanego białka (wynika to przede wszystkim od zawartości ww. aminokwasów). Mimo wysokiej czułości tych metod ograniczeniem jest dość niska swoistość, ponieważ wolna tyrozyna, tryptofan, kwas moczowy, a także pochodne puryny i pirymidyny mogą dawać reakcję dodatnią z odczynnikiem.
Tab. 5. Metody oznaczania białka całkowitego stosowane w analityce klinicznej.
W bezpośredniej metodzie spektrofotometrycznej wykorzystany został fakt absorpcji promieniowania elektromagnetycznego przez białka w zakresie UV (200-225 nm oraz 270-290 nm). Zwykle stosowana jest długość fali równa 280 nm. Absorpcja zależna jest od zawartości aminokwasów aromatycznych (tyrozyny i tryptofanu). Dlatego też, tak jak w metodach kolorymetrycznych, ograniczenie stanowi obecność wolnych aminokwasów w badanej próbce. Ponadto, bilirubina i kwas moczowy również absorbują promieniowanie przy 280 nm.
W sytuacji, gdy konieczne jest szybkie oszacowanie zawartości białka, zastosowanie znajduje metoda refraktometryczna. Wówczas oznaczenie białka wykonuje się na podstawie współczynnika załamania światła. Wyniki uzyskane tą metodą są nieprawidłowe w sytuacji, gdy stężenie białka całkowitego jest niższe od 3,5g/dL. W przypadku, gdy wynosi ono powyżej 11 g/dL, badaną próbkę należy rozcieńczyć wodą destylowaną.
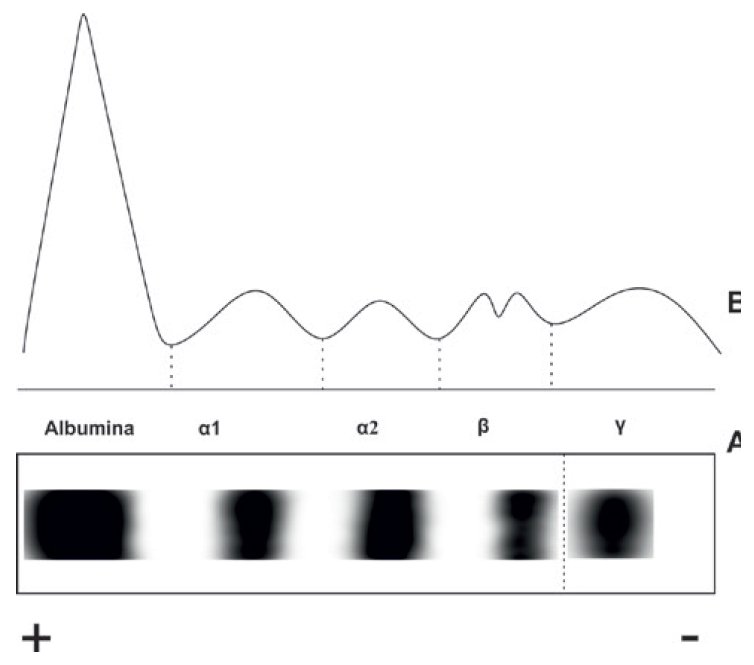
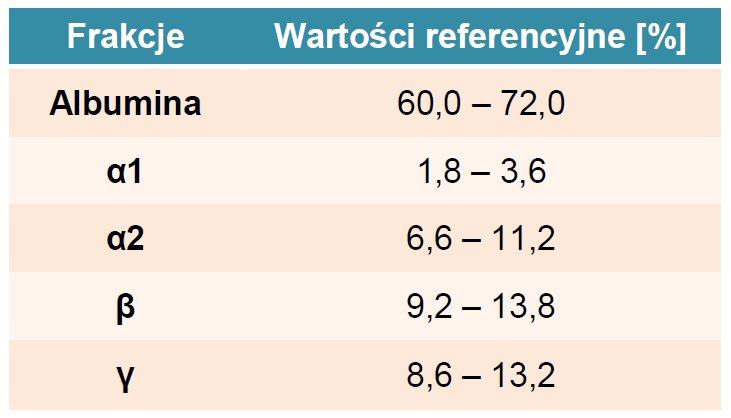
W celu dokładnej oceny ilościowej i jakościowej poszczególnych białek wykonywany jest proteinogram. Podstawową techniką pozwalającą na jego otrzymanie jest elektroforeza żelowa. W metodzie tej wykorzystywane jest zjawisko wędrowania białek w stałym polu elektrycznym. Poszczególne frakcje poruszają się z różną prędkością i ulegają rozdziałowi. Obecnie stosowane metody wykorzystują różne rodzaje podłoża i bufory o zasadowym pH. W takim środowisku większość białek wędruje w kierunku anody (albumina i α-globuliny). Białka zasadowe (γ-globuliny) zostają bliżej katody. Proteinogram pozwala na wyszczególnienie pięciu podstawowych grup białek: albumin, α1-globulin, α2-globulin, β-globulin i γ-globulin. Wykonując rozdział elektroforetyczny białek osocza obserwuje się również obecność fibrynogenu, który lokalizuje się między frakcją β oraz γ. Odchylenia od normy polegają na zmianach ilościowych i udziale procentowym poszczególnych białek w proteinogramie. By uzyskać wynik ilościowy dokonuje się odczytu densytometrycznego rozdziału elektroforetycznego.
Ryc. 2. A – prawidłowy rozdział elektroforetyczny białek osocza. B – Odczyt densytometru określający skład % frakcji.
Zmiany w puli białek niejednokrotnie mogą znajdować odzwierciedlenie w innych parametrach diagnostycznych. Przykładem jest pomiar szybkości opadania erytrocytów (krwinek czerwonych) zwany inaczej Odczynem Biernackiego (OB). Krwinki u osoby zdrowej opadają powoli (ich błony komórkowe są ujemnie naładowane – działają na nie siły wzajemnego odpychania). Białka krwi, w szczególności fibrynogen, łączy się z ujemnie naładowanymi błonami, neutralizując ich ładunek, promując adherencję, rulonizację przyspieszając jednocześnie ich opadanie. Test ten pozwala na ocenę zaburzeń proporcji pomiędzy stężeniami poszczególnych białek osocza i właściwościami erytrocytów.
Podsumowanie
W niniejszym artykule opisana została tylko po części rola jaką odgrywają białka w naszym organizmie, a także niektóre z podstawowych metod ich oznaczania. Wraz z rozwojem technik immunologicznych czy też analitycznych zakres prowadzonych badań uległ znacznemu rozszerzeniu, pozwalając z dużą dokładnością ocenić ilość konkretnych białek, a także całego spektrum białkowego w różnych rodzajach materiałów biologicznych. Coraz większe znaczenie odgrywa ocena unikalnych konfiguracji kilkudziesięciu lub kilkuset białek jednocześnie. Proteomika jest dziedziną nauki, zajmującą się równoczesną analizą mieszanin białkowych o złożonym składzie (np. lizatów komorkowych czy ekstraktów z homogenatów tkankowych). Analiza proteomiczna pozwala na ilościowe oznaczenie syntetyzowanego na matrycy mRNA białka, a także jego potranslacyjne modyfikacje. Zmiany te niejednokrotnie decydują o ich funkcji wewnątrz ustroju. Mając na uwadze hipotezę, iż „życie jest formą istnienia substancji białkowych” – analiza szerokiego profilu białkowego może pozwolić na określenie parametrów funkcjonowania całego organizmu.
PIŚMIENNICTWO:
1. A. Dubin: Wprowadzenie do chemii białek. Wydział biotechnologii UJ. Kraków, 2003.
2. B. Neumeister, I. Besenthal, B.O. Böhm: Diagnostyka laboratoryjna. wyd. II polskie, red. M. Pietruczuk, A. Bartoszko-Tyczkowska. Elsevier Urban & Partner. Wrocław, 2013.
3. A. Dembińska-Kieć, J.W. Naskalski: Diagnostyka laboratoryjna z elementami biochemii klinicznej. Elsevier Urban & Partner. Wrocław, 2009.
4. A. Szutowicz, A. Raszeja-Specht: Diagnostyka laboratoryjna, Tom II, Gdański Uniwersytet Medyczny. Gdańsk, 2011.





