Marek Gołębiowski
Uniwersytet Gdański, Wydział Chemii
Jednym z etapów każdej procedury analitycznej jest ekstrakcja, która polega na rozdzieleniu składników mieszaniny. Do ekstrakcji można stosować gazy, ciecze lub ciała stałe. Przykładowo, ekstrakcja rozpuszczalnikowa polega na przeniesieniu analitów z matrycy do niemieszającej się z nią fazy ciekłej. Zazwyczaj do tego typu ekstrakcji stosuje się rozpuszczalniki organiczne, takie jak: metanol, chloroform, heksan, dichlorometan, eter naftowy lub ich mieszaniny. Jedną z technik wykorzystujących ciała stałe do wyodrębniania analitów jest mikroekstrakcja do fazy stacjonarnej (Solid Phase Microextraction, SPME). SPME jest techniką ekstrakcyjną opracowaną przez Arthura i Pawliszyna w 1990 roku. Technika ta jest szczególnie pomocna, gdy celem analiz jest identyfikacja i analiza ilościowa lotnych i średniolotnych związków organicznych, a matryca jest bardzo złożona. Jest ona często stosowana w analizie różnorodnych surowców roślinnych, próbek środowiskowych, produktów spożywczych, a nawet lotnych związków emitowanych przez owady. Zestaw SPME oraz włókna przedstawiono na rysunku 1.
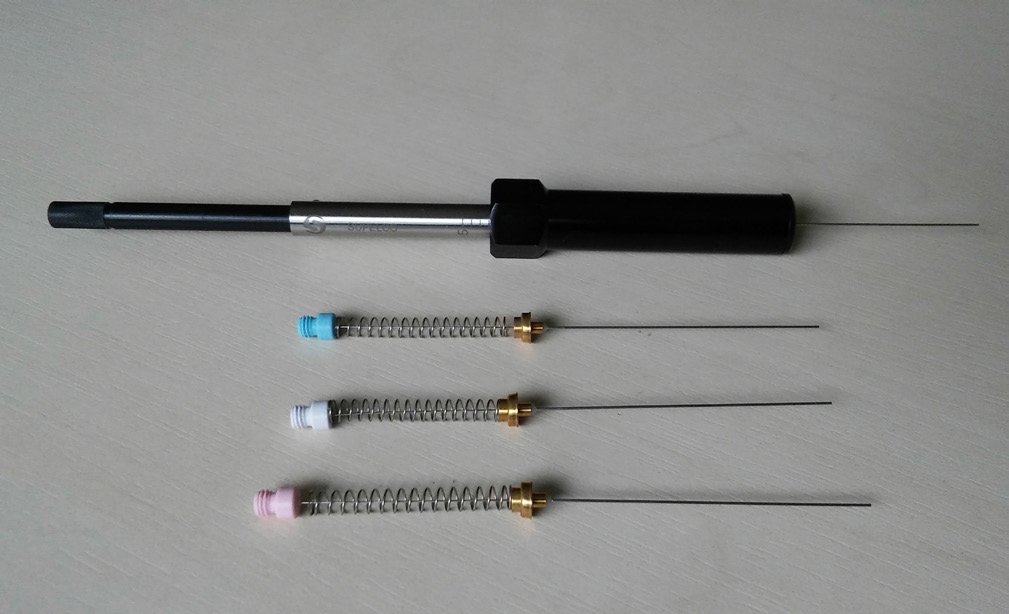
Rys. 1. Adapter i włókna SPME.
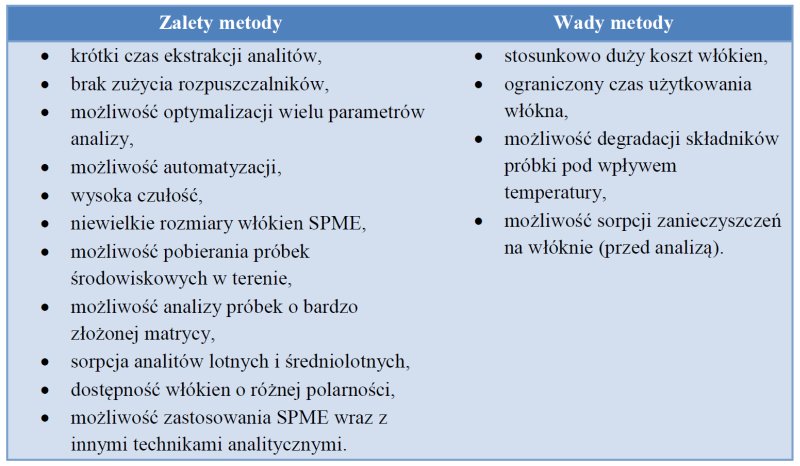
SPME polega na zaadsorbowaniu związków lotnych na włóknie kwarcowym, pokrytym odpowiednim materiałem sorpcyjnym (fazą stacjonarną). Metoda ta posiada wiele zalet w porównaniu z konwencjonalnymi metodami ekstrakcji. Najważniejszymi zaletami tej techniki jest prostota, niski koszt prowadzenia analiz i możliwość zastosowania w terenie, a co najważniejsze, nie jest techniką czasochłonną i nie wymaga użycia rozpuszczalników. Zestawienie zalet i wad SPME przedstawiono w tabeli 1.
Tab. 1. Zalety i wady SPME
Podczas ekstrakcji włókno może być umieszczone bezpośrednio w badanej próbce wodnej, a anality są przenoszone bezpośrednio z matrycy próbki do fazy stacjonarnej (direct immersion, DI-SPME) lub w gazowej fazie nadpowierzchniowej nad ciekłą lub stałą próbką (head space, HS-SPME).
SPME przebiega w dwóch podstawowych etapach. Pierwszym z nich jest adsorpcja analitów na powierzchni sorbentu. Włókno eksponowane jest na działanie składników próbki, a związki w niej obecne ulegają podziałowi pomiędzy sorbent a matrycę. Ilość zaadsorbowanego analitu zależna jest od wartości stałych podziału analitu pomiędzy matrycę próbki a fazę nadpowierzchniową oraz pomiędzy sorbent pokrywający włókno a fazę nadpowierzchniową. Drugim etapem jest desorpcja analitów pod wpływem wysokiej temperatury dozownika chromatografu gazowego. Anality uwalniane są do fazy gazowej i wraz z gazem nośnym transportowane na kolumnę chromatograficzną, gdzie ulegają rozdzieleniu, a następnie są wykrywane przez odpowiedni detektor.
Optymalizacja warunków analiz SPME
Kluczowym parametrem wpływającym na wydajność ekstrakcji i czułość metody jest współczynnik podziału, który zależy od temperatury, siły jonowej roztworu, polarności matrycy próbki, a także rodzaju materiału włókna. Na czułość oznaczenia mogą wpływać również: objętość fazy stacjonarnej, fazy nadpowierzchniowej i próbki. Ważnym parametrem jest także czas ekstrakcji, który zależy od temperatury i intensywności mieszania. Ogólnie można stwierdzić, że wszystkie parametry wpływające na współczynnik podziału determinują czułość, selektywność oraz wydajność metody.
Bardzo ważnym etapem podczas stosowania mikroekstrakcji do fazy stacjonarnej jest optymalizacja warunków całego procesu. Najważniejszymi parametrami są:
- rodzaj włókna,
- grubość filmu fazy stacjonarnej,
- rodzaj próbki,
- mieszanie,
- objętość próbki,
- wartość pH,
- wysalanie,
- temperatura ekstrakcji,
- czas ekstrakcji,
- parametry desorpcji,
- dobór parametrów pracy chromatografu gazowego.
Rodzaj fazy stacjonarnej jaką pokryte jest włókno SPME determinuje selektywność i czułość metody. Sorbent powinien charakteryzować się odpowiednimi właściwościami chemicznymi i fizycznymi, które pozwolą osiągnąć optymalną wydajność ekstrakcji. W zależności od potrzeb stosuje się włókna o różnej polarności:
- niepolarne – PDMS (polidimetylosiloksan),
- polarne – PA (poliakrylan),
- mieszane – PDMS/DVB (polidimetylosiloksan/polidiwinylobenzen),
- mieszane – DVB/CAR/PDMS (polidimetylosiloksan/polidiwinylobenzen/carboxen),
- mieszane – PDMS/CAR (polidimetylosiloksan/carboxen),
- mieszane – CW/DVB (carbowax/polidiwinylobenzen),
- mieszane – CW/TPR (carbowax/żywica z nadrukiem molekularnym),
- mieszane – PDMSDVB/CAR (polidimetylosiloksan/polidiwinylobenzen/carboxen).
Grubość filmu fazy stacjonarnej wpływa na czułość metody i czas ekstrakcji. Zastosowanie fazy stacjonarnej o dużej grubości wydłuża czas sorpcji, ale dzięki temu sorbują się większe ilości analitów. Z kolei cienka warstwa fazy stacjonarnej zapewnia szybką dyfuzję analitów i łatwe uwalnianie związków organicznych podczas ich termicznej desorpcji. W związku z tym, włókna o większej grubości warstwy fazy stacjonarnej stosuje się do ekstrakcji lotnych związków, a włókna o mniejszej grubości stosuje się do izolacji i wzbogacania związków o wysokiej temperaturze wrzenia. Dostępne są włókna o następującej grubości warstwy sorbentu: 7, 10, 30, 50, 65, 70, 85 i 100 μm.
Bardzo ważnym czynnikiem jest rodzaj matrycy oraz lotność analitów. Próbki o wysokiej czystości mogą być ekstrahowane bezpośrednio, natomiast ekstrakcję z fazy nadpowierzchniowej stosuje się do izolowania lotnych związków organicznych ze względu na szybkość osiągania równowagi w takim układzie.
Kolejnym czynnikiem wpływającym na czas ekstrakcji jest mieszanie próbki. Zastosowanie mieszania skraca czas osiągnięcia stanu równowagi międzyfazowej, co znacznie ułatwia transport analitów z próbki do włókna SPME.
Ważnym czynnikiem wpływającym na wydajność ekstrakcji jest objętość próbki, która jest znacznie większa niż objętość fazy stacjonarnej, a ilość ekstrahowanych analitów jest proporcjonalna do objętości fazy stacjonarnej na włóknie. Objętości próbki należy dobrać tak, aby osiągnąć maksymalne stężenie analitu przy minimalnej objętości fazy gazowej.
Również wartość pH i wysalanie są istotnymi czynnikami wpływającymi na efektywność ekstrakcji. Obniżenie wartości pH próbki powoduje cofnięcie dysocjacji kwaśnych analitów, a tym samym poprawę czułości procedury analitycznej, natomiast dodatek soli do próbki (najczęściej NaCl lub Na2SO4) powoduje wzrost wartości stałej podziału, a także siły jonowej roztworu. Zmniejsza to rozpuszczalność substancji organicznych w wodzie, przez co zwiększa się ilość analitów, które są sorbowane na włóknie.
Parametrami poddawanymi optymalizacji są również temperatura i czas ekstrakcji. Wraz ze wzrostem temperatury rośnie współczynnik dyfuzji, co zwiększa szybkość ekstrakcji. Zastosowanie wyższej temperatury powoduje szybszy transport lotnych składników próbki do fazy nadpowierzchniowej. Optymalną temperaturę ekstrakcji wyznacza się doświadczalne na podstawie wykresu zależności intensywności sygnału analitu i wartości zmienianej temperatury ekstrakcji. Optymalną temperaturę osiąga się wtedy, gdy ilość wyekstrahowanego analitu jest największa. Również doświadczalnie wyznacza się optymalny czas ekstrakcji (w stałej temperaturze). Ekstrakcję należy prowadzić do momentu osiągnięcia stanu równowagi pomiędzy próbką a fazą stacjonarną włókna. Czas ustalenia się równowagi międzyfazowej to czas, po upływie którego ilość ekstrahowanych analitów pozostaje stała i można uznać, że ekstrakcja analitów na włóknie jest zakończona.
Stosując SPME można jednocześnie przeprowadzić derywatyzację niektórych analitów. Derywatyzacja zwiększa lotność, obniża polarność i reaktywność analitów, co z kolei zwiększa czułość i selektywność analiz. Derywatyzację można prowadzić:
- bezpośrednio w matrycy „in situ”,
- na włóknie SPME,
- w komorze dozownika chromatografu.
Derywatyzacja bezpośrednio w matrycy polega na dodaniu do analizowanej próbki odczynnika derywatyzującego, a po zajściu reakcji otrzymane pochodne ekstrahuje się do włókna SPME. Derywatyzacja na włóknie SPME polega na impregnowaniu włókna odczynnikiem derywatyzującym, a następnie anality są izolowane z matrycy do włókna i tam w dalszej kolejności ulegają derywatyzacji. Derywatyzacja w komorze dozownika chromatografu polega na wprowadzeniu analitu do włókna w postaci pary jonowej, a następnie do dozownika chromatografu gazowego, gdzie pod wpływem wysokiej temperatury zachodzi reakcja derywatyzacji.
Bardzo ważnym etapem analizy SPME jest desorpcja analitów w dozowniku chromatografu gazowego. Desorpcja termiczna uzależniona jest, podobnie jak sorpcja, od szeregu czynników, do których zliczyć można temperaturę dozownika chromatografu gazowego, lotność analitów, grubości sorbentu, a także czas trwania desorpcji. Wzrost temperatury desorpcji powoduje obniżenie wartości stałej podziału oraz wzrost wartości współczynnika dyfuzji analitów, co zwiększa efektywność ich uwalniania. Optymalną temperaturą desorpcji jest temperatura wrzenia najmniej lotnego analitu. Czas desorpcji wynosi od 1 sek do 2 min, ale w celu wyeliminowania efektu pamięci włókno powinno pozostać w dozowniku 5-10 minut.
W zależności od grubości filmu, producenci włókiem określili maksymalną temperaturę desorpcji dla poszczególnych typów włókien [Banel i Zygmunt, 2008]:
PDMS 100 µm – 280 °C; 30 µm – 280 °C; 7 µm – 340 °C,
PA 85 µm – 320 °C,
PDMS/DVB 65 µm – 270 °C; 60 µm – 270 °C,
PDMS/CAR 75 µm – 320 °C,
CW/DVB 65 µm – 265 °C,
CW/TPR 50 µm – 270 °C,
PDMS/DVB/CAR 50 µm – 270 °C; 30 µm – 270 °C.
Również same warunki pracy chromatografu gazowego należy dostosować do właściwości analizowanych związków. Najważniejszymi parametrami są: temperatura początkowa i końcowa, narost oraz temperatura dozownika i detektora. Temperatura początkowa kolumny powinna być utrzymywana na niskim poziomie i powinna być niższa o 80-100 °C od temperatury wrzenia najbardziej lotnego analitu. Dozownik powinien być ustawiony na pracę w układzie bez dzielenia strumienia. Należy również wybrać odpowiednią kolumnę chromatograficzną, która powinna charakteryzować się dużą sprawnością i selektywnością oraz powinna być stabilna termicznie.
Przykłady zastosowań SPME
Jak wcześniej wspomniano, technikę SPME wykorzystano m.in. do analiz próbek środowiskowych, produktów spożywczych, surowców roślinnych i owadów. Przykładowo, technikę tę zastosowano w analizie:
- Chemicznych środków bojowych i produktów ich degradacji. Przetestowano 5 różnych włókien SPME: 85 µm (PA), 65 µm (PDMS/DVB), 75 µm (CAR/PDMS), 50/30 µm (DVB/CAR/PDMS) i 60 µm (PEG). Do oznaczeń końcowych zastosowano GC/MS/MS (SRM - Monitorowanie wybranych reakcji fragmentacji) [Nawała i inni, 2016].
- Lotnych metabolitów grzybów. Przetestowano 4 różne włókna SPME: 100 µm (PDMS), 85 µm (PA), 75 µm (CAR/PDMS) i 50/30 µm (CAR/DVB/PDMS). Do oznaczeń końcowych zastosowano GC/MS (TIC – Całkowity prąd jonowy) [Jeleń, 2003].
- Perytroidów w ogórkach i arbuzach. Przetestowano 3 różne włókna SPME: 100 µm (PDMS), 60 µm (PDMS/DVB) i 50 µm (CW/TPR). Do oznaczeń końcowych zastosowano HPLC/PIF/FD (PIF/FD – Fotochemicznie indukowana derywatyzacja z detekcją fluorescencyjną) [Vazquez i inni, 2008].
- Pestycydów w wodach gruntowych. Zastosowano włókno 65 µm (PDMS/DVB). Do oznaczeń końcowych zastosowano GC/MS (SIM – Monitorowanie wybranych jonów) i GC/FPD (FPD – Detektor płomieniowo-fotometryczny) [Tomkins i Ilgner, 2002].
- Metabolitów leków w wydychanym powietrzu. Zastosowano włókno 75 µm (CAR/PDMS). Do oznaczeń końcowych zastosowano GC/MS (TIC) [Lu i inni, 2017].
- Związków zapachowych sera koziego. Zastosowano włókno 50/30 µm (DVB/ CAR/PDMS). Do oznaczeń końcowych zastosowano GC/MS (TIC) [Delgado i inni, 2011]
- Lotnych związków z wydzielin szarańczy pustynnej Schistocerca gregaria. Przetestowano 5 różnych włókien SPME: 75 µm (PDMS), 85 µm (PA), 60 µm polyethylenglycol (PEG), 65 µm (PDMS/DVB) i 100 µm (PDMS). Do derywatyzacji zastosowano N,O-bis(trimetylosililo)trifluoroacetamid (BSTFA). Do oznaczeń końcowych zastosowano GC/MS (TIC/SIM) [Reitz i inni, 2015].
- Lotnych związków organicznych z mąki zaatakowanej przez Tribolium castaneum. Zastosowano włókno 50/30 µm (DVB/CAR/PDMS). Do oznaczeń końcowych zastosowano GC/FID (FID – Detektor płomieniowo-jonizacyjny) i GC/MS (TIC) [Niu i inni, 2016].
- Kutikularnych węglowodorów termitów. Przetestowano 3 różne włókna SPME: 100 µm (PDMS), 70 µm (CW/DVB) i 75 µm (CAR/PDMS). Do oznaczeń końcowych zastosowano GC/MS (TIC) [Bland i inni, 2001].
Podsumowując, można stwierdzić, że względu na swoje liczne zalety, SPME znalazła szerokie zastosowanie w analizie lotnych i średniolotnych związków organicznych. Możliwość zastosowania SPME w połączeniu z innymi technikami analitycznymi sprawiła, że technika ta stała się bardzo często wykorzystywana w analityce zanieczyszczeń środowiska, analizie żywności, badaniach klinicznych, analizie toksykologicznej, badaniach biomedycznych i badaniach związków pochodzenia
naturalnego.
Literatura:- Arthur C. L., Pawliszyn J., Solid phase microextraction with thermal desorption using fused silica optical fibers. Analytical Chemistry 62 (1990) 2145–2148.
- Banel A., Zygmunt B., Zastosowanie połączenia mikroekstrakcji do fazy stacjonarnej i chromatografii gazowej do oznaczania lotnych kwasów tłuszczowych W próbkach środowiskowych i pokrewnych. Ecological Chemistry and Engineering S 15 (2008) 7-28.
- Bland J. M., Osbrink W. L. A., Cornelius M. L., Lax A. R., Vigo C. B., Solid-phase microextraction for the detection of termite cuticular hydrocarbons. Journal of Chromatography A, 932 (2001) 119–127.
- Delgado F. J., González-Crespo J., Cava R., Ramírez R., Formation of the aroma of a raw goat milk cheese during maturation analysed by SPME–GC–MS. Food Chemistry 129 (2011) 1156–1163.
- Jeleń H. H., Use of solid phase microextraction (SPME) for profiling fungal volatile metabolites. Letters in Applied Microbiology 36 (2003) 263–267.
- Lu Y., Niu W., Zou X., Shen C., Xia L., Huang C., Wang H., Jiang H., Chu Y., Glass bottle sampling solid phase microextraction gaschromatography mass spectrometry for breath analysis of drugmetabolites. Journal of Chromatography A, 1496 (2017) 20–24.
- Nawała J., Czupryński K., Popiel S., Dziedzic D., Bełdowski J., Development of the HS-SPME-GC-MS/MS method for analysis of chemical warfare agent and their degradation products in environmental samples. Analytica Chimica Acta 933 (2016) 103-116.
- Niu Y., Hardy G., Agarwal M., Hua L., Ren Y., Characterization of volatiles Tribolium castaneum (H.) in flour using solidphase microextraction–gas chromatography mass spectrometry (SPME–GCMS). Food Science and Human Wellness 5 (2016) 24–29.
- Reitz M., Gerhardt H., Schmitt C., Betz O., Albert K., Lämmerhofer M., Analysis of chemical profiles of insect adhesion secretions by gas chromatography–mass spectrometry. Analytica Chimica Acta 854 (2015) 47–60.
- Tomkins B. A., Ilgner R. H., Determination of atrazine and four organophosphorus pesticides in ground water using solid phase microextraction (SPME) followed by gas chromatography with selected-ion monitoring. Journal of Chromatography A, 972 (2002) 183–194.
- Vazquez P. P., Mughari A. R., Galera M. M., Solid-phase microextraction (SPME) for the determination of pyrethroids in cucumber and watermelon using liquid chromatography combined with post-column photochemically induced fluorimetry derivatization and fluorescence detection. Analytica Chimica Acta 607 (2008) 74–82.





