Piotr Hildebrandt
Blirt S.A.
strony wersji drukowanej: 32-34
strony wersji drukowanej: 32-34
Białka to makrocząsteczki zbudowane z kilkuset reszt aminokwasowych połączonych ze sobą w określonej kolejności, posiadających zorganizowaną strukturę przestrzenną, niekiedy zmodyfikowanych poprzez przyłączenie łańcucha węglowodanów. Mogą one pełnić szereg różnych funkcji m.in.: być biokatalizatorem, cząsteczką sygnalną, bądź terapeutykiem - niejednokrotnie łączącym te obie funkcje. Synteza chemiczna białek, przy obecnym zaawansowaniu technologicznym, jest bardzo trudna, ze względu na ich skomplikowaną budowę. Z tego powodu najczęściej w celu produkcji określonego białka wykorzystuje się wyspecjalizowane narzędzia biologiczne, takie jak: komórki mikroorganizmów, linie komórkowe czy też rośliny lub zwierzęta transgeniczne. Pełnią one funkcję niejako małych fabryk produkujących białka docelowe. Wykorzystanie tych narzędzi umożliwił silny rozwój technik DNA in vitro dzięki opanowaniu konstrukcji plazmidów rekombinantowych będących nośnikami informacji, które można wprowadzić do komórek. Plazmidy rekombinantowe to odpowiednio zbudowane cząsteczki DNA stanowiące przepis na produkcję białka, składające się z promotora, czyli fragmentu DNA pozwalającego na kontrolę biosyntezy, genu – fragmentu DNA niosącego informację o budowie aminokwasowej białka oraz terminatora – fragmentu DNA stanowiącego nakaz zakończenia składania z „cegiełek życia” danego pojedynczego białka. W zależności od samego białka, jak i wydajności procesu jego wytwarzania, stosowane narzędzia biologiczne różnią się przydatnością. Białka, które nie są zmodyfikowane i składają się jednie z reszt aminokwasowych, jak niektóre enzymy, antygeny czy toksyny, są bardzo dobrze wytwarzane przez bakteryjne (np. Escherichia coli) lub/i drożdżowe komórki (np. Pichia pastoris). Natomiast proteiny, takie jak ludzkie przeciwciała monoklonalne, które mają ogromne znaczenie jako substancje czynne leków, mogą być poprawnie wytworzone jedynie przy zastosowaniu ludzkich linii komórkowych takich jak linie komórkowe HEK293. Przy wyborze właściwego narzędzia należy wziąć pod uwagę strategię produkcji samej proteiny. Trzeba zdecydować, czy dane białko ma zostać przetransportowane po biosyntezie przez komórkę na zewnątrz, czy też może pozostać w jej wnętrzu przez cały proces produkcji. W celu ukierunkowania transportu białka stosuje się informacje poprzedzające sam gen, które po biosyntezie znakują białko i są rozpoznawane przez komórkę. Zaletą wytwarzania białka na zewnątrz komórki jest niejednokrotnie łatwiejszy proces jego oczyszczania. Przy takiej strategii stosowane narzędzia biologiczne różnią się zdolnością przeprowadzania transportu. W przypadku, gdy białko docelowe posiada w swej strukturze mostki disiarczkowe powstałe przez dimeryzację grup -SH dwóch cystein, większą zdolnością prawidłowego składania białka cechują się komórki drożdżowe i komórki organizmów wyższych. Zalety i wady dostępnych narzędzi biologicznych do celu biosyntezy białek zostały przedstawione w tabeli 1. Pomimo braku możliwości produkcji białek zmodyfikowanych, jak i słabych zdolności poprawnego składania białek zawierających mostki disiarczkowe w aktywną cząsteczkę, komórki Escherichia coli są jednym z najczęściej wybieranym narzędziem biologicznym do biosyntezy. Za wyborem tego narzędzia przemawia nie tylko krótki czas konieczny od projektu do gotowego białka - gdyż konstrukcja plazmidu i sama produkcja białek odbywa się tutaj najszybciej, ale także cena - gdyż otrzymanie nawet powyżej 10 gram białka z 1 litra hodowli czyni proces opłacalnym. W sytuacji gdy białko docelowe posiada mostki disulfidowe i nie wymaga obecności właściwej modyfikacji cukrowej, alternatywą dla komórek bakteryjnych w przypadku biosyntezy są komórki drożdżowe. Zawsze wówczas, gdy istnieje tylko szansa na wykorzystanie komórek bakterii lub drożdży do produkcji białka, wybiera się te narzędzia.
Plazmidy rekombinantowe to odpowiednio zbudowane cząsteczki DNA stanowiące przepis na produkcję białka, składające się z promotora, czyli fragmentu DNA pozwalającego na kontrolę biosyntezy, genu – fragmentu DNA niosącego informację o budowie aminokwasowej białka oraz terminatora – fragmentu DNA stanowiącego nakaz zakończenia składania z „cegiełek życia” danego pojedynczego białka. W zależności od samego białka, jak i wydajności procesu jego wytwarzania, stosowane narzędzia biologiczne różnią się przydatnością. Białka, które nie są zmodyfikowane i składają się jednie z reszt aminokwasowych, jak niektóre enzymy, antygeny czy toksyny, są bardzo dobrze wytwarzane przez bakteryjne (np. Escherichia coli) lub/i drożdżowe komórki (np. Pichia pastoris). Natomiast proteiny, takie jak ludzkie przeciwciała monoklonalne, które mają ogromne znaczenie jako substancje czynne leków, mogą być poprawnie wytworzone jedynie przy zastosowaniu ludzkich linii komórkowych takich jak linie komórkowe HEK293. Przy wyborze właściwego narzędzia należy wziąć pod uwagę strategię produkcji samej proteiny. Trzeba zdecydować, czy dane białko ma zostać przetransportowane po biosyntezie przez komórkę na zewnątrz, czy też może pozostać w jej wnętrzu przez cały proces produkcji. W celu ukierunkowania transportu białka stosuje się informacje poprzedzające sam gen, które po biosyntezie znakują białko i są rozpoznawane przez komórkę. Zaletą wytwarzania białka na zewnątrz komórki jest niejednokrotnie łatwiejszy proces jego oczyszczania. Przy takiej strategii stosowane narzędzia biologiczne różnią się zdolnością przeprowadzania transportu. W przypadku, gdy białko docelowe posiada w swej strukturze mostki disiarczkowe powstałe przez dimeryzację grup -SH dwóch cystein, większą zdolnością prawidłowego składania białka cechują się komórki drożdżowe i komórki organizmów wyższych. Zalety i wady dostępnych narzędzi biologicznych do celu biosyntezy białek zostały przedstawione w tabeli 1. Pomimo braku możliwości produkcji białek zmodyfikowanych, jak i słabych zdolności poprawnego składania białek zawierających mostki disiarczkowe w aktywną cząsteczkę, komórki Escherichia coli są jednym z najczęściej wybieranym narzędziem biologicznym do biosyntezy. Za wyborem tego narzędzia przemawia nie tylko krótki czas konieczny od projektu do gotowego białka - gdyż konstrukcja plazmidu i sama produkcja białek odbywa się tutaj najszybciej, ale także cena - gdyż otrzymanie nawet powyżej 10 gram białka z 1 litra hodowli czyni proces opłacalnym. W sytuacji gdy białko docelowe posiada mostki disulfidowe i nie wymaga obecności właściwej modyfikacji cukrowej, alternatywą dla komórek bakteryjnych w przypadku biosyntezy są komórki drożdżowe. Zawsze wówczas, gdy istnieje tylko szansa na wykorzystanie komórek bakterii lub drożdży do produkcji białka, wybiera się te narzędzia.
 Plazmidy rekombinantowe to odpowiednio zbudowane cząsteczki DNA stanowiące przepis na produkcję białka, składające się z promotora, czyli fragmentu DNA pozwalającego na kontrolę biosyntezy, genu – fragmentu DNA niosącego informację o budowie aminokwasowej białka oraz terminatora – fragmentu DNA stanowiącego nakaz zakończenia składania z „cegiełek życia” danego pojedynczego białka. W zależności od samego białka, jak i wydajności procesu jego wytwarzania, stosowane narzędzia biologiczne różnią się przydatnością. Białka, które nie są zmodyfikowane i składają się jednie z reszt aminokwasowych, jak niektóre enzymy, antygeny czy toksyny, są bardzo dobrze wytwarzane przez bakteryjne (np. Escherichia coli) lub/i drożdżowe komórki (np. Pichia pastoris). Natomiast proteiny, takie jak ludzkie przeciwciała monoklonalne, które mają ogromne znaczenie jako substancje czynne leków, mogą być poprawnie wytworzone jedynie przy zastosowaniu ludzkich linii komórkowych takich jak linie komórkowe HEK293. Przy wyborze właściwego narzędzia należy wziąć pod uwagę strategię produkcji samej proteiny. Trzeba zdecydować, czy dane białko ma zostać przetransportowane po biosyntezie przez komórkę na zewnątrz, czy też może pozostać w jej wnętrzu przez cały proces produkcji. W celu ukierunkowania transportu białka stosuje się informacje poprzedzające sam gen, które po biosyntezie znakują białko i są rozpoznawane przez komórkę. Zaletą wytwarzania białka na zewnątrz komórki jest niejednokrotnie łatwiejszy proces jego oczyszczania. Przy takiej strategii stosowane narzędzia biologiczne różnią się zdolnością przeprowadzania transportu. W przypadku, gdy białko docelowe posiada w swej strukturze mostki disiarczkowe powstałe przez dimeryzację grup -SH dwóch cystein, większą zdolnością prawidłowego składania białka cechują się komórki drożdżowe i komórki organizmów wyższych. Zalety i wady dostępnych narzędzi biologicznych do celu biosyntezy białek zostały przedstawione w tabeli 1. Pomimo braku możliwości produkcji białek zmodyfikowanych, jak i słabych zdolności poprawnego składania białek zawierających mostki disiarczkowe w aktywną cząsteczkę, komórki Escherichia coli są jednym z najczęściej wybieranym narzędziem biologicznym do biosyntezy. Za wyborem tego narzędzia przemawia nie tylko krótki czas konieczny od projektu do gotowego białka - gdyż konstrukcja plazmidu i sama produkcja białek odbywa się tutaj najszybciej, ale także cena - gdyż otrzymanie nawet powyżej 10 gram białka z 1 litra hodowli czyni proces opłacalnym. W sytuacji gdy białko docelowe posiada mostki disulfidowe i nie wymaga obecności właściwej modyfikacji cukrowej, alternatywą dla komórek bakteryjnych w przypadku biosyntezy są komórki drożdżowe. Zawsze wówczas, gdy istnieje tylko szansa na wykorzystanie komórek bakterii lub drożdży do produkcji białka, wybiera się te narzędzia.
Plazmidy rekombinantowe to odpowiednio zbudowane cząsteczki DNA stanowiące przepis na produkcję białka, składające się z promotora, czyli fragmentu DNA pozwalającego na kontrolę biosyntezy, genu – fragmentu DNA niosącego informację o budowie aminokwasowej białka oraz terminatora – fragmentu DNA stanowiącego nakaz zakończenia składania z „cegiełek życia” danego pojedynczego białka. W zależności od samego białka, jak i wydajności procesu jego wytwarzania, stosowane narzędzia biologiczne różnią się przydatnością. Białka, które nie są zmodyfikowane i składają się jednie z reszt aminokwasowych, jak niektóre enzymy, antygeny czy toksyny, są bardzo dobrze wytwarzane przez bakteryjne (np. Escherichia coli) lub/i drożdżowe komórki (np. Pichia pastoris). Natomiast proteiny, takie jak ludzkie przeciwciała monoklonalne, które mają ogromne znaczenie jako substancje czynne leków, mogą być poprawnie wytworzone jedynie przy zastosowaniu ludzkich linii komórkowych takich jak linie komórkowe HEK293. Przy wyborze właściwego narzędzia należy wziąć pod uwagę strategię produkcji samej proteiny. Trzeba zdecydować, czy dane białko ma zostać przetransportowane po biosyntezie przez komórkę na zewnątrz, czy też może pozostać w jej wnętrzu przez cały proces produkcji. W celu ukierunkowania transportu białka stosuje się informacje poprzedzające sam gen, które po biosyntezie znakują białko i są rozpoznawane przez komórkę. Zaletą wytwarzania białka na zewnątrz komórki jest niejednokrotnie łatwiejszy proces jego oczyszczania. Przy takiej strategii stosowane narzędzia biologiczne różnią się zdolnością przeprowadzania transportu. W przypadku, gdy białko docelowe posiada w swej strukturze mostki disiarczkowe powstałe przez dimeryzację grup -SH dwóch cystein, większą zdolnością prawidłowego składania białka cechują się komórki drożdżowe i komórki organizmów wyższych. Zalety i wady dostępnych narzędzi biologicznych do celu biosyntezy białek zostały przedstawione w tabeli 1. Pomimo braku możliwości produkcji białek zmodyfikowanych, jak i słabych zdolności poprawnego składania białek zawierających mostki disiarczkowe w aktywną cząsteczkę, komórki Escherichia coli są jednym z najczęściej wybieranym narzędziem biologicznym do biosyntezy. Za wyborem tego narzędzia przemawia nie tylko krótki czas konieczny od projektu do gotowego białka - gdyż konstrukcja plazmidu i sama produkcja białek odbywa się tutaj najszybciej, ale także cena - gdyż otrzymanie nawet powyżej 10 gram białka z 1 litra hodowli czyni proces opłacalnym. W sytuacji gdy białko docelowe posiada mostki disulfidowe i nie wymaga obecności właściwej modyfikacji cukrowej, alternatywą dla komórek bakteryjnych w przypadku biosyntezy są komórki drożdżowe. Zawsze wówczas, gdy istnieje tylko szansa na wykorzystanie komórek bakterii lub drożdży do produkcji białka, wybiera się te narzędzia.Przeciwciała monoklonalne, które mają szerokie zastosowanie w przemyśle farmaceutycznym, cechują się wysoką specyficznością rozpoznawania antygenu, fragmentu danego białka, oraz wymagają obecności modyfikacji w postaci odpowiednich grup cukrowych. Struktura samych reszt węglowodanowych białka jest w tym przypadku istotna, gdyż decyduje również o immunogenności substancji aktywnej. Dlatego też w takich przypadkach wykorzystuje się unieśmiercone linie komórkowe komórek ludzkich, które produkują te białka na zewnątrz komórki. Zmuszenie tych komórek do ukierunkowanej biosyntezy jest dużo trudniejsze niż w przypadku prokariotycznych układów ze względu na problemy ze stabilnością takich komórek (wówczas gdy dostarczany plazmid funkcjonuje jako cząsteczka autonomiczna) oraz z wydajnością otrzymania stabilnych, wydajnie produkujących linii komórkowych (ze względu na fakt wysokiej organizacji genomowego DNA tych komórek i wyłączenia z użycia dużej części tej informacji genetycznej). W tym przypadku konieczne jest stosowanie odpowiednich protokołów gwarantujących szybką selekcję odpowiedniego klona komórek rekombinantowych.
Po wyborze właściwego dla danego białka narzędzia biologicznego do biosyntezy należy wziąć pod uwagę także właściwość przepisu, który wprowadzany jest do komórki. Komórki, począwszy od bakterii, aż do komórek ludzkich, wykorzystują jeden język- kod genetyczny. Kod genetyczny zbudowany z czterech różnych par zasad po przepisaniu go na użyteczne w etapie biosyntezy białka cząsteczki matrycowego RNA, zostaje przepisany na strukturę białka poprzez identyfikację kolejno ułożonych po sobie kodonów, zbudowane z trzech par nukleotydów. Jest 64 możliwości różnego ułożenia trzech nukleotydów, ale reszt aminokwasowych budujących białka w organizmach żywych jest 20. Trzy z możliwości wykorzystywane są jako sygnał zakończenia budowy białka z reszt aminokwasowych, natomiast pozostała część jest przypisana do różnych reszt aminokwasowych. Zdolność „interpretacji” tych sygnałów przez komórkę różni się w zależności od organizmu. Można powiedzieć, że występują różne gwary języka, jakim jest kod genetyczny, stosowane przez komórki. Ostatnio opanowanie techniki syntezy genów in silico pozwalają na skonstruowanie plazmidu rekombinantowego niosącego informację o budowie białka we właściwej gwarze, tj. zoptymalizowanej dla danego rozwiązania biologicznego.
Tabela 1. Porównanie narzędzi biologicznych do produkcji białek.
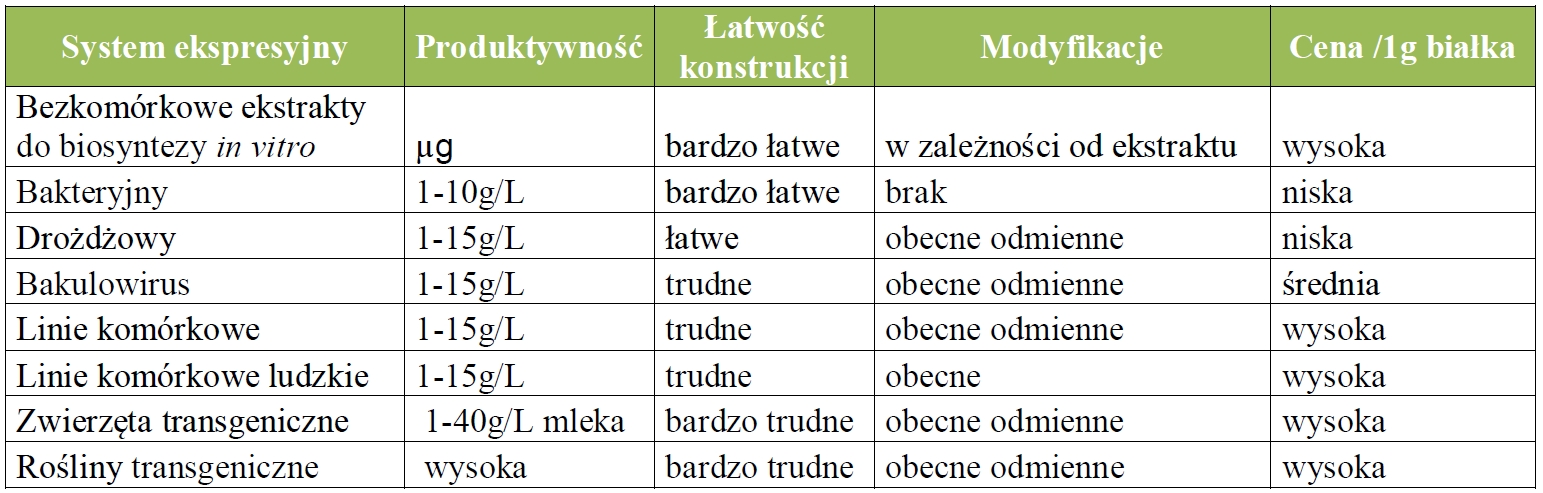
Tabela 1. Porównanie narzędzi biologicznych do produkcji białek.

Wyodrębnianie białka
Posiadając mini fabrykę do produkcji białka wykorzystuje się ją do ukierunkowanej biosyntezy według przyjętych założeń. Podobnie jak w przypadku syntez chemicznych, związki chemiczne, białko otrzymane przy pomocy jednego z narzędzi biologicznych nie jest pozbawione zanieczyszczeń. W celu otrzymania czystego preparatu białka wykorzystuje się szereg technik separacji takich jak: separacja na zasadzie sita, ekstrakcja czy techniki chromatograficzne. Niektóre z tych metod zostały stworzone specjalnie do celów wyodrębniania tego typu molekuł z mieszaniny. Etap oczyszczania podczas produkcji białka jest jednym z najtrudniejszych. Z tego względu opracowano szereg metod ułatwiających separację jak np. znakowanie białka poprzez dołączenie domeny ułatwiającej ten etap. Domeny te przyłączane są na etapie inżynierii genetycznej - budowania przepisu na białko, w taki sposób, ażeby możliwe było oddzielenie białka docelowego od tej domeny przy zastosowaniu narzędzi biologii molekularnej takich jak specyficzna proteoliza. Wadą tego ułatwienia jest niekiedy pozostałość w białku docelowym pochodząca z domeny oczyszczającej po jej odłączeniu, która może mieć wpływ na aktywność białka. Strategię rozdzielania białek bez takiej domeny opracowuje się w oparciu o narzędzia bioinformatyczne, dostarczające informacji o właściwościach biofizycznych białka, takich jak punkt izoelektryczny czy stopień hydrofobowości. Jednak z reguły konieczne jest przeprowadzenie szeregu doświadczeń optymalizacyjnych w celu dobrania właściwych warunków separacji. Warto wspomnieć, że w celu oczyszczenia białka do poziomu przewyższającego 95% konieczne jest zastosowanie kombinacji metod separacji.
Formulacja białek
Proteiny przeważnie charakteryzują się niską stabilnością. Niektóre z nich wykazują tendencję do tworzenia agregatów, bądź też podatne są na degradację. Z tego względu żeby zagwarantować stabilność białka, tak aby mogło być wykorzystane w doświadczeniach lub też jako narzędzie, wymagane jest dobranie właściwych warunków roztworu, w którym się ono znajduje. Stosuje się wówczas przyśpieszone testy stabilności, testy zamrażania i rozmrażania, które przeprowadzone przy wykorzystaniu odpowiedniej ilości dobranych warunków i wyrafinowane techniki analityczne jak rozdzielanie chromatograficzne z ciekła fazą ruchomą ze spektrometrią masową, pozwalają na określenie najlepszych składników roztworu do przechowywania.





