Thomas Jocks, Dierk Roessner
Wyatt Technology Europe, Dernbach, Niemcy
strony wersji drukowanej: 32-37
strony wersji drukowanej: 32-37
Od wynalezienia syntetycznych polimerów istnieje ogromne zapotrzebowanie aby poznawać ich ciężary cząsteczkowe i rozmiary bez robienia a priori jakichkolwiek założeń odnośnie struktury molekularnej. Wynika ono z faktu, że właściwości polimerów zależą zarówno od ich rozmiarów jak i składu chemicznego. Również zakres rodzajów analizowanych próbek wzrósł znacząco od pierwszych analiz elastomerów i syntetycznych polimerów, ponieważ zauważono, że wiele funkcji biologicznych jest kontrolowanych przez masę molową, rozmiary i kształt.
Pierwsze pomiary absolutne (absolutne, tzn. przeprowadzane bez odnoszenia się do wzorców) oparte były na podstawowych zasadach fizycznych i ich powiązaniu z masą cząsteczkową. Najbardziej użytecznymi z nich były:
- osmometria membranowa – dyfuzja poprzez membranę;
- sedymentacja – opadanie cząstek, udoskonalona do postaci techniki ultrawirowania analitycznego;
- spektrometria mas – wyznaczająca masę cząsteczkową, ale niszcząca próbkę.
Inne instrumentalne podejście możliwe było z rozwinięciem techniki opartej na rozpraszaniu światła opracowanej przez: Einsteina1, Ramana2, Debye’a3, Zimma4-5 i innych6-7. Problemem w pomiarach za pomocą osmometrii membranowej i sedymentacji jest to, że podają one tylko wypadkowe właściwości próbki polimerowej bez żadnego bardziej szczegółowego rozróżnienia. Ponadto pomiary były nadzwyczaj czasochłonne i wrażliwe na błędy operatora. W celu uzyskania informacji o mieszaninach polidyspersyjnych konieczne było opracowanie metody rozdzielania różnych rozmiarów cząsteczek. Osiągnięto to z nastaniem HPSEC (High Performance Size Exclusion Chromatography) wysokorozdzielczej chromatografii żelowej zwanej również SEC (Size Exclusion Chromatography – chromatografią wykluczania molekularnego) lub GPC (Gel Permeation Chromatography – chromatografią sączenia molekularnego). Zasada SEC oparta jest na tym, że pory złoża w kolumnach chromatograficznych mają rozmiary umożliwiające czasowe wniknięcie do nich cząsteczek. W trakcie przemieszczania się próbki przez kolumnę, małe cząsteczki w porównaniu z dużymi przez dłuższy czas przebywają wewnątrz tych pustych przestrzeni. Dzięki temu próbka ulega rozdzieleniu ze względu na objętość hydrodynamiczną Vh (tj. objętość kłębka polimerowego w roztworze, która zależy od jakości oddziaływania polimeru z rozpuszczalnikiem i masy cząsteczkowej polimeru). Ostatecznie duże cząsteczki wymywane są wcześniej niż małe.
Wybierając kolumnę z odpowiednim materiałem wypełniającym można uzyskać określoną rozdzielczość systemu. Kolumny można również połączyć szeregowo aby zwiększyć rozdzielczość lub badany zakres wielkości.
Uzyskawszy odpowiednią metodę rozdziałową, następnym krokiem jest przekształcenie wielkości czasu, przy którym wymywana jest próbka (czas elucji lub czas retencji) na masę cząsteczkową. Przy znanej masie cząsteczkowej czas, przy którym wymywany jest standard jest równy określonej masie cząsteczkowej. Stosując wiele standardów można skonstruować krzywą kalibracyjną masy cząsteczkowej w funkcji czasu elucji. To był swego czasu znaczący postęp w analizie polimerów ponieważ można było wykazać, że polimery złożone są z różnych składników, których rodzaj i dystrybucja mogą również wpływać na właściwości fizyczne. Jednak niedoskonałości takiej metody są oczywiste: nieznana próbka jest zawsze porównywana ze znanymi standardami a te mogą się znacząco różnić od badanej próbki. Wyniki uzyskane za pomocą SEC są następnie matematycznie przetwarzane na dane, podobne do tych, które można uzyskać innymi technikami. Tak jest również w przypadku stosowania instrumentów z tzw. potrójną detekcją. Ich kalibracja jest zawsze zależna od tego czy zastosowany model matematyczny nadaje się do obliczeń mas cząsteczkowych w przypadku danej próbki. W gruncie rzeczy nie można automatycznie postulować takiego założenia.
Nieodłącznym problemem jest to, że system jest kalibrowany zgodnie z charakterystyką objętości hydrodynamicznych standardów Vh, które nie są wprost związane z masą cząsteczkową. Jeżeli zależność pomiędzy masą cząsteczkową a Vh próbki nie jest taka sama jak w przypadku wzorca wówczas kalibracja jest nieprawidłowa. Zatem aby pomiar był dokładny, do kalibracji powinien być użyty taki sam polimer o identycznej konformacji i być w takim samym eluencie jak badana próbka (wielkość powłoki hydratacyjnej zmienia Vh). Co więcej, nie powinno być innych oddziaływań z materiałem wypełniającym kolumnę niż tych wynikających z efektów sterycznych lub elektrostatycznych. Oczywiście dużą część prac HPSEC przeprowadzano z zastosowaniem wzorców polimerowych oczekując, że będą one w określony sposób podobne do właściwości badanych cząsteczek. Jednak ponieważ wymagania dotyczące jakości polimerów wzrosły, konieczność uzyskiwania absolutnych wartości również się zwiększyła. Jest to szczególnie istotne w aplikacjach farmaceutycznych, gdzie nawet bardzo niewielka zmiana masy cząsteczkowej (np. agregacja) lub kształtu może wpłynąć na aktywność biologiczną. Zmiany takie mogą wręcz wywoływać niekorzystny efekt zamiast leczniczego.
Rozwiązaniem problemu z kalibracją stało się połączenie absolutnego detektora rozpraszania światła z systemem frakcjonującym.Tradycyjne instrumenty rozpraszania światła pracowały zbierając odczyty z różnych kątów pomiarowych po kolei. We wczesnych latach 70-tych opracowano detektor rozpraszania światła pod małym kątem8, który pozwalał na obliczenie masy cząsteczkowej z pojedynczego pomiaru. I chociaż pomiary pod małymi kątami są problematyczne ze względu na fundamentalne zasady fizyczne (cząsteczki mają tendencję do silniejszego rozpraszania światła w kierunku małych kątów niż w kierunku większych, a rozpraszanie pod małymi kątami spowodowane przez cząstki kurzu i zanieczyszczenia fazy ruchomej z łatwością przesłaniają rozpraszanie od badanych cząsteczek), małokątowe rozpraszanie światła laserowego (low-angle laser light scattering – LALLS) stało się popularne w latach 70-tych i do połowy lat 80-tych.
Połowa lat 80-tych to nastanie instrumentów wielokątowego rozpraszania światła laserowego9, które były w stanie na przeprowadzanie pomiarów pod kilkoma kątami jednocześnie, a już pod koniec lat 80-tych10-12 połączenie detektorów wielokątowego rozpraszania światła laserowego (MALS) z systemem SEC stało się praktyczną propozycją umożliwiającą wyznaczanie masy i wielkości w każdej części frakcji polimerowej. Rozwój instrumentów wielokątowego rozpraszania światła laserowego był znacząco wsparty rosnącą wydajnością urządzeń obliczeniowych potrzebnych do przetwarzania danych.
Wielokątowe rozpraszanie światła laserowego (MALS)
MALS może być stosowane do badania polimerów syntetycznych, białek, środków farmaceutycznych i cząstek, jak np.: liposomy, micele oraz otoczkowane (enkapsulowane) białka. Pomiary mogą być przeprowadzane w jednym z dwóch trybów: wsadowym, gdzie próbka nie jest przed pomiarem frakcjonowana oraz w trybie przepływowym (z SEC, HPLC lub inną metodą frakcjonowania przepływowego). Eksperymenty w trybie wsadowym można przeprowadzać wprowadzając próbkę strzykawką do celki przepływowej lub w specjalnych fiolkach. Tego typu badania prowadzi sięw celu określenia zmian zależnych od czasu jak oddziaływania przeciwciało—antygen lub składanie białek (protein assembly). W trybie wsadowym można również wyznaczyć drugi współczynnik wirialny (A2), wartość, która jest skorelowana z prawdopodobieństwem krystalizacji lub agregacji w danym rozpuszczalniku (użyteczna przy krystalizacji białek). Pomiary w trybie ciągłym mogą być stosowane do badania różnego rodzaju próbek, których rodzaj nie jest praktycznie ograniczony. Firma Wyatt Technology opracowała nawet pomiary procesów przebiegających w naczyniu reakcyjnym poprzez sprzężenie próbnika z reaktorem (reactor bleed) z detektorem MALS. Na ogół jednak, detektory łączone są z różnego rodzaju systemami chromatograficznymi. Zalety systemu frakcjonującego połączone są tutaj ze zdolnością wyznaczania masy cząsteczkowej i wielkości cząsteczek w każdej wymywanej objętości elucji.

Rysunek 1. Instrumenty Wyatt Technology: Eclipse (FFF) połączony z DAWN II (MALS) i Optilab T-reX (RI) w sprzężeniu z systemem HPLC.
W pomiarach MALS do obliczeń wykorzystuje się całkowitą intensywność rozproszonego światła mierzoną przy wszystkich kątach pomiarowych instrumentu. Umożliwia to pokonanie problemów występujących w detektorach mierzących rozpraszanie światła pod małymi kątami (na ogół szum przy kącie 11º lub mniejszym jest 10 razy większy niż przy 90º) pozwalając na wiarygodne i dokładne pomiary rozproszonego światła. Co więcej,detektory Wyatt’a DAWN i miniDAWN są jedynymi instrumentami na rynku, które wykorzystują kalibrację toluenem. Tylko detektory kalibrowane toluenem pracują bez założeń i bez wzorców mas cząsteczkowych. Im większa liczba kątów detekcji tym może być większa dokładność eksperymentu, oczywiście pod warunkiem, że do obliczeń i analizy danych zastosuje się najbardziej wyrafinowane algorytmy matematyczne, co nie jest bynajmniej regułą we wszystkich innych instrumentach rozpraszania światła na rynku. Dodatkowo w DAWN stosunek sygnału do szumu jest nieporównywalnie lepszy.
Ilość rozproszonego światła jest związana z masą cząsteczkową za pomocą następującego równania:
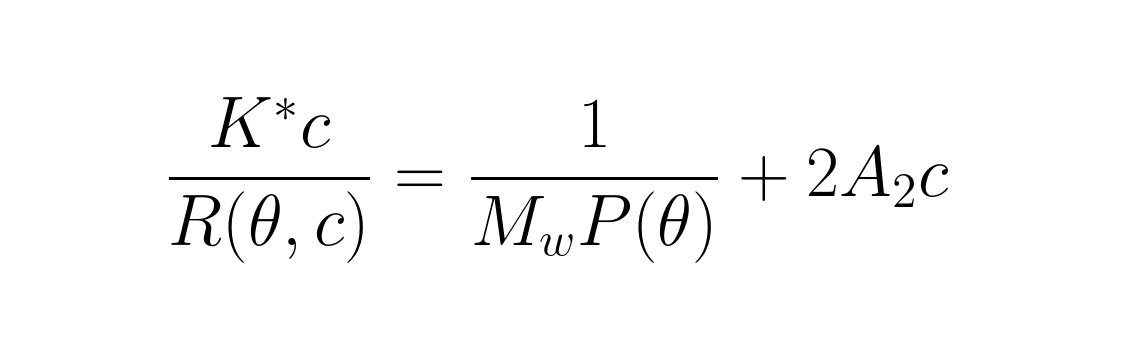
(dla pełnego wyjaśnienia tego równania i dalszych informacji proszę zobaczyć stronę: www.wyatt.eu / theory)
Masa cząsteczkowa i wielkość obliczane są następnie przez utworzenie wykresu Debye dla wszystkich danych z każdego wycinka chromatogramu:
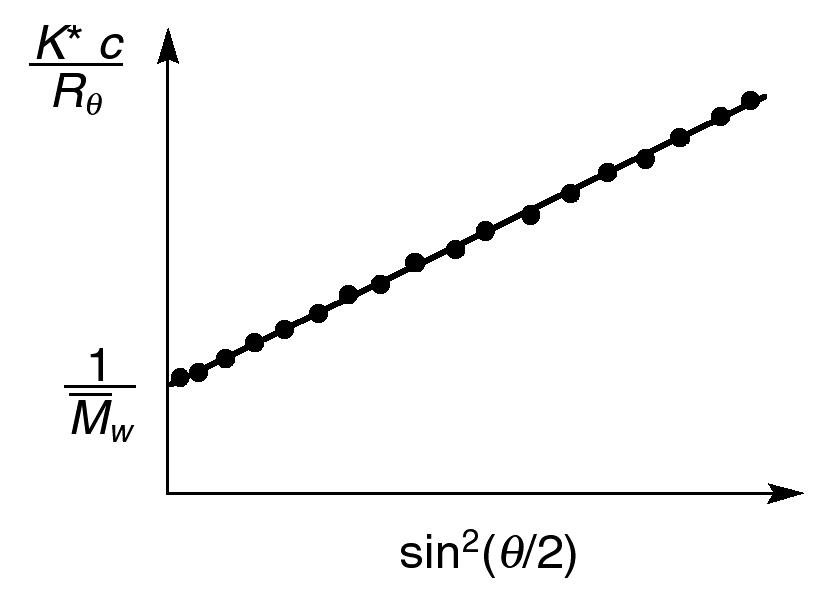
Rysunek 2. Wykres Debye: a) przecięcie z osią rzędnych daje MW dla tego wycinka; b) nachylenie pozwala określić średnią kwadratową promienia (RMS lub Rg) dla tego wycinka – patrz dalej.
Po co stosować detekcję rozpraszania światła?
Włączenie detektora MALS za systemem chromatograficznym pozwala wykorzystać SEC lub inną metodę rozdzielania w połączeniu z korzyściami absolutnej metody detekcyjnej. Sygnał rozpraszania światła zależy wyłącznie od iloczynu masy cząsteczkowej i stężenia; czas elucji nie ma znaczenia a wzorce mas są archaiczne. Rozdział innych próbek może być łatwo przeprowadzony bez ponownej kalibracji. W dodatku można również zastosować inne sposoby rozdzielania, niekoniecznie oparte o wielkość, jak np. chromatografię HPLC lub IC.
Ponieważ sygnał rozpraszania światła jest zależny od iloczynu masy i stężenia, detektor staje się bardziej czuły wraz ze wzrostem masy. Dzięki temu detektor MALS jest świetnym narzędziem do badania agregacji. Im większy stopień agregacji tym detektor staje się czulszy.
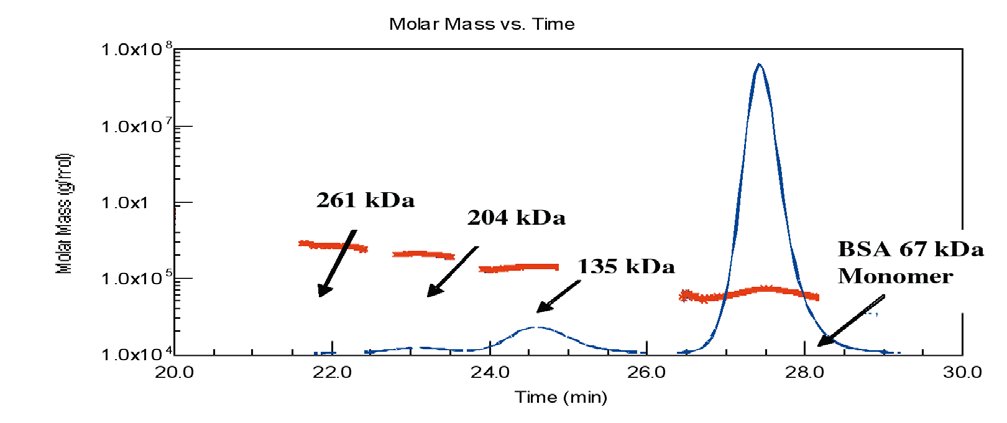
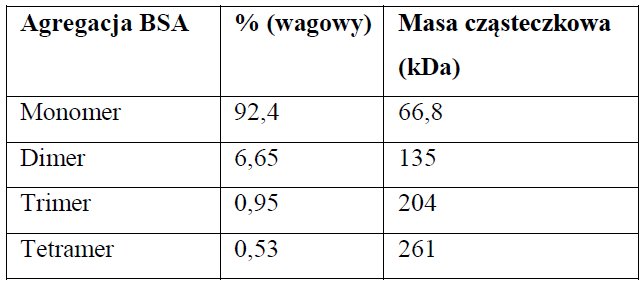
Rysunek 3. Wykrywanie agregatów BSA za pomocą MALS (MW względem czasu).
Jak wcześniej wspomniano, detektor MALS może również dostarczyć informacji o wielkości cząsteczki. Tą informacją jest średnia kwadratowa promienia cząsteczki (RMS - Root Mean Square radius lub Rg). Różni się ona od wspomnianego Rh tym, że nie zależy od sfery hydratacyjnej i jest obliczona jako średnia kwadratowa wszystkich promieni cząsteczek, z których składa się molekuła, pomnożonych przez masę przy danym promieniu (patrz Rysunek 4).
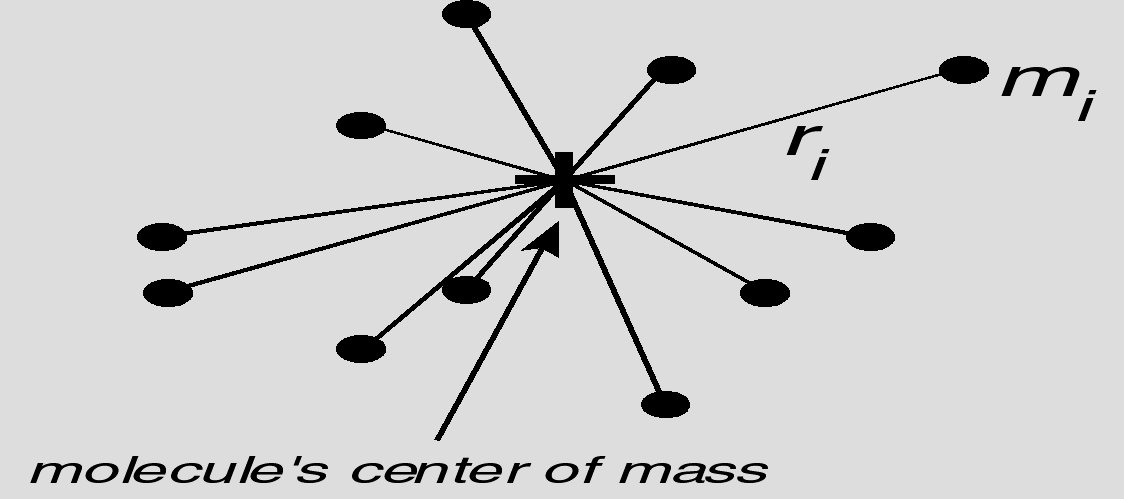
Rysunek 4. Promień RMS (środek ciężkości cząsteczki).
Może się to wydawać dziwnym parametrem pomiarowym, ale w gruncie rzeczy jest bardzo użyteczny, gdyż jest wrażliwy na zmiany kształtu cząsteczki. Jeśli rozważymy przyłączenie bocznej grupy do dużej cząsteczki (rozgałęzienie), spowoduje ono znikomą zmianę Rh, ale znacząco wpłynie na Rg. Dodatkowo, jeżeli wykreśli się zależność log Rg względem log M wówczas można określić kształt cząsteczki.
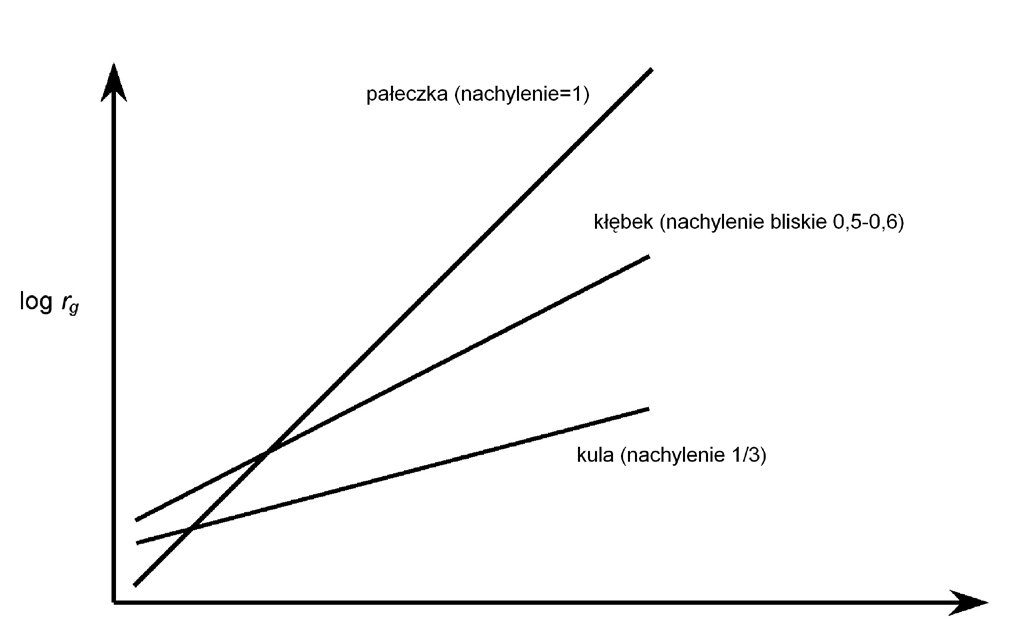
Rysunek 5. Pomiar różnych konformacji cząsteczkowych.
Jeżeli występują jakiekolwiek zmiany kształtu, które są związane ze zmianą masy cząsteczkowej, to będą one zidentyfikowane, jak pokazano na rysunku 6.
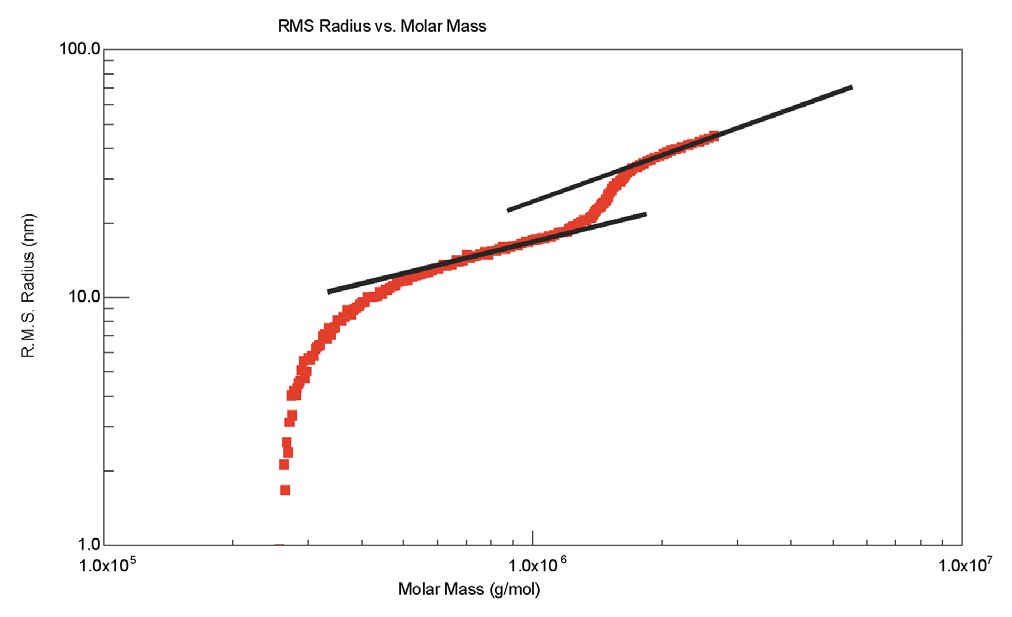
Rysunek 6. Białka soczewki wykazują zmianę kształtu ze wzrostem masy cząsteczkowej.
Sprzężenie MALS z frakcjonowaniem AF4
Alternatywą dla klasycznych chromatograficznych metod rozdziałowych może być frakcjonowanie przepływowe w asymetrycznym polu sił przepływu (Asymmetric-Flow Field-Flow-Fractionation; AF4). Jest to jednofazowa, niedestruktywna metoda rozdzielania makrocząstek stosowana przed ich dalszą charakterystyką i wyznaczaniem mas cząsteczkowych oraz wielkości w roztworze. Obecnie jest powszechnie stosowana w analizie polimerów, białek, biopolimerów i cząstek. W AF4 składniki wymywane przy określonych czasach retencji związane są z objętościami hydrodynamicznymi zatrzymywanych cząsteczek. Próbka pozostaje niezmieniona przez fazę stacjonarną. W porównaniu do chromatografii żelowej (SEC), AF4 ma znacznie szerszy zakres zastosowań oraz posiada dodatkowe korzyści, jak zmniejszone ryzyko degradacji przez ścinanie (shearing degradation), brak oddziaływań z matrycą materiału wypełniającego kolumnę oraz możliwość nastrzykiwania dużych objętości próbek.
Podsumowanie
Technika wielokątowego rozpraszania światła w połączeniu z SEC lub innymi metodami rozdziałowymi pozwala na wyznaczanie w sposób absolutny mas cząsteczkowych, wielkości i dystrybucji wszelkiego rodzaju makro-cząsteczek. Detektory MALS Wyatt Technology pozwalają także na uzyskanie dodatkowych informacji, jak stopień rozgałęzienia, konformacja i zachowanie w eluencie. Co więcej, te same instrumenty pozwalają na obserwowanie oddziaływań międzycząsteczkowych w czasie rzeczywistym. Nadzwyczajna czułość i wszechstronność, czynią z nich doskonałe narzędzia do szczegółowej charakterystyki polimerów i innych dużych cząsteczek.
W odróżnieniu od systemów z potrójną detekcją oraz tzw. metod z ,,absolutną” kalibracją, tylko MALS rzeczywiście pozwala na wyznaczenie masy i wielkości cząsteczek w sposób bezwzględny, gdyż korzysta z pierwszych zasad fizycznych. Ta technika pomiarowa jest niewrażliwa na rodzaj stosowanego mechanizmu rozdzielania i jako taka jest idealna zarówno do rozmaitych zastosowań naukowych, jak i rutynowej kontroli jakości wcześniej przebadanych próbek. W wielu przypadkach sprzężenie MALS z urządzeniem rozdziałowym AF4, jak np. Eclipse firmy Wyatt, daje najbardziej wszechstronne narzędzie do badań naukowych.
Piśmiennictwo:
1. A. Einstein, Ann. Phys. 33 (1910), 1275
2. C.V. Raman, Indian J. Phys. 2 (1927), 1
3. P.Debye, J. Appl. Phys. 15 (1944), 338
4. B.H. Zimm, J. Chem. Phys 13 (1945), 141
5. B.H. Zimm, J. Chem. Phys 16 (1948), 1093
6. B.H. Zimm, R.S. Stein and P. Dotty, Pol. Bull. 1,(1945), 90
7. M. Fixman, J. Chem. Phys. 23 (1955), 2074
8. A.C. Ouano and W. Kaye J. Poly. Sci. A1(12) (1974), 1151
9. Flow Through MALS detector, DLS 800, Science Spectrum Inc.
10. P.J. Wyatt, C. Jackson and G.K. Wyatt Am. Lab 20(6) (1988), 86
11. P.J. Wyatt, D. L. Hicks, C. Jackson and G.K. Wyatt Am. Lab. 20(6) (1988), 106
12. C. Jackson, L.M. Nilsson and P.J. Wyatt J. Appl. Poly. Sci. 43 (1989), 99
Dr. Thomas Jocks, Dr. Dierk Roessner
Wyatt Technology Europe GmbH
Hochstrasse 18, D-56307 Dernbach, Deutschland
tel. +49 2689 925 0 fax +49 2689 925 299
E-mail: Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
Tłumaczenie: Jacek Achrem-Achremowicz





