Patrycja Koszałka
Zakład Biologii Komórki, Katedra Biotechnologii Medycznej Międzyuczelniany Wydział Biotechnologii UG i GUMed, Gdański Uniwersytet Medyczny
strony wersji drukowanej: 24-29
strony wersji drukowanej: 24-29

Ludzkość zawsze była zainteresowana kontrolowaniem cech fenotypowych (ogół cech organizmu mających podłoże genetyczne modyfikowanych przez wpływy środowiska) zwierząt jak np. masy ciała i jakości mięsa u zwierząt rzeźnych, prędkości biegu u konia czy ilości i wielkości jajek składanych przez kury. Także w przypadku zwierząt domowych jak np. psów, kotów czy myszy, dzięki czemu powstały ich stałe rasy, znacząco różniące się cechami fenotypowymi między sobą i to nie tylko wyglądem ale także takimi cechami jak podatność na niektóre schorzenia czy agresywność. Od tysięcy lat pożądane cechy były selekcjonowane i rozprzestrzeniane w populacji poprzez staranne krzyżowanie wybranych par rodzicielskich. Zwykle polegało to na selekcjonowaniu cech już występujących w populacji, ale których natężenie nie było stałe i charakteryzowało się rozkładem Gaussa w populacji. W ten sposób można było utrwalić cechy rzadko występujące w populacji a pożądane np. krzyżując świnie o najszybszym przyroście masy ze sobą lub największych psów w stadzie. Często jednak polegało to na selekcjonowaniu spontanicznych mutacji, które od czasu do czasu pojawiają się w populacji. Takie mutacje jeśli były użyteczne lub po prostu wyglądały interesująco hodowcy starali się utrzymywać w populacji. Jako przykład użytecznej mutacji można tu podać odmianę bydła zwaną belgijską błękitną (Belgian Blue) będącą rasą mięsną (dochodzą do 2 ton masy) ze względu na tzw. ‘podwójne umięśnienie’ wynikające z mutacji w genie miostatyny, genie, którego produkt odpowiedzialny jest za ograniczenie przyrostu mięśni. Jako interesującą mutację ze względów estetycznych można wskazać tutaj mutację związaną z prawidłowym formowaniem sierści u rasy kotów Cornish Rex. Jednakże czasami częstotliwość spontanicznych mutacji była dla hodowców niewystarczająca i stosowali oni mutageny chemiczne lub fizyczne. Przykładem jest tutaj uzyskanie szczepu myszy o czarnym ubarwieniu (nonagouti) za pomocą mutagenu chemicznego.
W ciągu tysiącleci w wyniku selektywnego krzyżowania uzyskano olbrzymią różnorodność ras zwierząt hodowlanych i domowych. Jednakże ta nadmierna specjalizacja ras zwierząt doprowadziła do licznych zaburzeń rozwojowych. Selektywne krzyżowanie pozwoliło na utrzymanie w populacji niepożądanych cech fenotypowych, których loci są sprzężone z loci cech pożądanych i zgodnie z teorią dziedziczenia Morgana ulegają wspólnemu przekazaniu do potomstwa. Dla ras kur, których selektywne krzyżowanie oraz wyselekcjonowanie spontanicznych mutacji trwa już 10 tysięcy lat dzięki czemu uzyskaliśmy rasy zdolne składać 300 jaj rocznie, daje to jednocześnie znacząco zwiększoną agresywność tych zwierząt (nie jest to jedynie efekt hodowania na niewielkiej powierzchni), postępującą degenerację kości czy też zaburzenia układu immunologicznego. Rasy bydła o zwiększonej mleczności mają zwiększoną podatność na zakażenia bakteryjne prowadzące do zapalenia wymion oraz zwiększoną podatność na spontaniczną aborcję (5% płodów ulega aborcji do 40 dnia ciąży) oraz posiada słabsze potomstwo (10% cielaków umiera w wieku do 10 dni). Rasy mięsne bydła, gdzie można mówić o tzw. „syndromie dużego potomstwa” wymagają interwencji weterynaryjnej przy porodzie. A wspomnieć jeszcze trzeba o odwrotnej korelacji między tempem wzrostu a płodności zwierząt, czyli im masa danej rasy szybciej przyrasta tym są one mniej płodne. Zabrnęliśmy więc już w ślepą uliczkę selekcji, zwłaszcza w przypadku zwierząt hodowlanych i należy zamienić metody tak by móc uzyskać takie zwierzęta, które zaspokoją ciągle wzrastający popyt populacji ludzkiej na produkty odzwierzęce. Kolejnym krokiem naprzód może być więc modyfikacja genetyczna zwierząt metodami nowoczesnej biotechnologii. Nie będzie to znacząca zmiana kierunku, bo jak widzimy genetyczne modyfikowanie zwierzęta towarzyszą nam już od tysięcy lat, jedynie nie są to modyfikacje wprowadzone w zamierzony sposób przez nas a zmiany przypadkowe, niekontrolowane, mogące być zarówno pożyteczne jak i wręcz szkodliwe, zarówno w przypadku mutacji spontanicznych jak i zastosowania przez nas mutagenów chemicznych lub fizycznych.
Inżynieria genetyczna pozwala nam na wprowadzenie pożądanej cechy do genomu zwierzęcia z dużą wydajnością i pod sporą kontrolą uzyskanych rezultatów. I w tym przypadku zwykle posługujemy się terminem zwierzęta transgeniczne, od transgenu czyli fragmentu materiału genetycznego, który został przeniesiony z jednego organizmu do innego. Fragment ten może zawierać gen kodujący białko lub funkcjonalne RNA i tak być skonstruowany aby po wbudowaniu do genomu ulegać wydajnej ekspresji. Może też zostać użyty do wprowadzenia zmiany w sekwencji genomu np. w wyniku rekombinacji homologicznej, pozwalającej na wymianę fragmentów sekwencji między dwoma cząsteczkami DNA (jak w przypadku procesu crossing-over). W tym drugim przypadku, ze względu na niską częstotliwość zajścia procesu rekombinacji homologicznej (zwykle 0,1-10 % wszystkich przypadków rekombinacji) metoda uzyskiwania zwierząt transgenicznych musi pozwolić na wyselekcjonowania komórek w których zaszedł ten typ rekombinacji (są to zwykle metody z użyciem zarodkowych komórek pnia jak i transferu jądrowego). Najpopularniejsze obecnie metody uzyskiwania zwierzęcia transgenicznego, pozwalają na wprowadzenie zmiany w taki sposób, że modyfikacja jest dziedziczona przez potomstwo, a więc modyfikacji zostały poddane także komórki linii płciowej: spermatogonia produkujące plemniki i oogonia, przekształcające się w oocyty. W metodach tych wykorzystujemy modyfikację genetyczną embriona przedimplantacyjnego: zapłodnionej komórki jajowej, moruli czy niezagnieżdżonej jeszcze blastocysty. Na tym etapie jesteśmy w stanie zmodyfikować komórki embriona, które dopiero na dalszych etapach rozwoju embrionalnego przekształcą się w komórki linii płciowej i będą chronione przed możliwymi modyfikacjami przez komórki je otaczające. Dodatkowo takie embriony można wyizolować a następnie przez krótki czas utrzymywać poza organizmem w celu modyfikacji a następnie ponownego wprowadzenia do układu rozrodczego. Aby zmodyfikować taki embrion możemy bezpośrednio do przedjądrza męskiego (jest to haploidalne jądro plemnika, który wniknął do komórki jajowej) zapłodnionej komórki jajowej wprowadzić za pomocą delikatnej szklanej igły nasz materiał genetyczny zawierający transgen i liczyć na to, że ulegnie on wbudowaniu do genomu. Możemy użyć retrowirusa, który ma zdolność wbudowywania się do genomu, jako biologicznego nośnika naszego transgenu i użyć go do zakażenia embriona przedimplantacyjnego. Możemy także użyć zarodkowych komórek pnia, komórek wyizolowanych z wewnętrznej masy blastocysty, które to komórki zwykle utworzyłyby większość embriona a mogą być utrzymywane w hodowli bez utraty potencjału do różnicowania. Takie komórki możemy modyfikować in vitro a następnie wprowadzić ponownie do nowej blastocysty, licząc na to, że połączą się z komórkami wewnętrznej masy i utworzą organizm chimeryczny, częściowo zbudowany z komórek modyfikowanych a częściowo z niezmodyfikowanych. Możemy zmodyfikować także komórkę somatyczną w hodowli in vitro a następnie wprowadzić jej jądro do niezapłodnionej komórki jajowej pozbawionej materiału genetycznego (tzw. ooplast) i pobudzić taką komórkę do podziałów oraz utworzenia embriona przedimplantacyjnego. Są oczywiście także inne metody ale wszystkie one służą uzyskaniu zwierzęcia o wybranej przez nas, pożądanej modyfikacji genetycznej. Są to metody oczywiście kosztowne i pracochłonne. Pytanie tylko czy ten koszt i praca się opłacają?
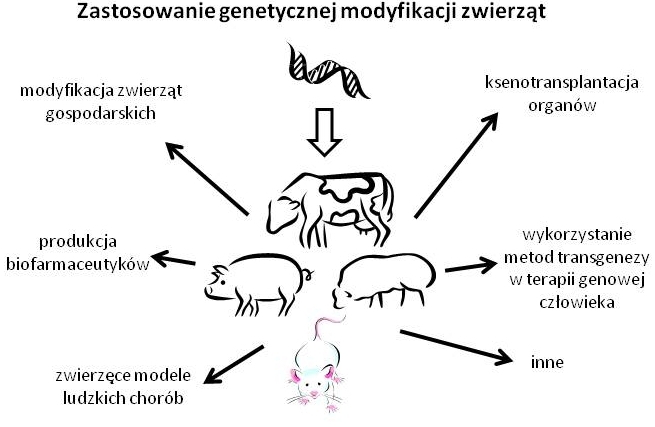
Najbardziej oczywistym zastosowaniem takich zwierząt transgenicznych jest ulepszenie zwierząt gospodarskich. Czasami są to modyfikacje, których logika jest bardzo prosta jak np. wprowadzenie genu wyrażającego hormon wzrostu łososia do genomu tilapii, karpia, okonia, ostryg, małży czy krewetek. Dla tilapii obecność tego hormonu oznacza znacząco szybszy wzrost (3-11 razy) jak i zwiększoną odporność na zimno. Jednakże co z innymi zwierzętami gospodarskimi, jak krowy i świnie, u których zwiększony przyrost masy oznacza problemy z porodem? Proste podejście czyli wprowadzenie genu wyrażającego ludzki czynnik wzrostu do genomu świni nie tylko znacząco zmniejszyło płodność tych zwierząt ale także zwiększyło ich problemy zdrowotne. Zastosowano więc zupełnie inne podejście. Wyprodukowano transgeniczne świnie mające ekspresję bydlęcej laktoalbuminy zwiększając w ten sposób znacząco stężenie białka w mleku czym uzyskano przyspieszony przyrost masy zwierząt karmionych takim mlekiem (brak „syndromu dużego potomstwa” przy narodzinach takich zwierząt) i zmniejszone problemy zdrowotne. Ale nie tylko przyrost masy może być regulowany, także skład mleka zwierząt - w taki sposób, że zostanie on dostosowany do spożycia przez niemowlęta i osoby z zaburzeniami żywienia. Wprowadzenie dodatkowych kopii bydlęcych genów kodujących kazeiny mleka do bydła mlecznego znacząco zwiększyło przyswajalność mleka z układu pokarmowego a w 2009 roku opatentowano metodę uzyskiwania mleka o niskiej zawartości laktozy poprzez genetyczną modyfikację zwierząt.
Możemy także zmniejszyć prawdopodobieństwo pojawienia się patogenów w produktach odzwierzęcych oraz sprawić że same zwierzęta będą zdrowsze. Co trzecia krowa mleczna ulega zakażeniu patogenami wywołującymi zapalenie wymion a mleko takiej krowy jest niezdatne do spożycia przez człowieka. W ciągu ostatnich lat wyprodukowano transgeniczne krowy wyrażające lizostafinę rozkładającą peptydoglikany S. aureus, głównego patogenu wywołującego zapalenie wymion jak i krowy wyrażające ludzkie geny kodujące naturalne peptydy przeciwba kteryjne: lizozym i laktoferynę znacząco zwiększające oporność tych zwierząt na to schorzenie. Przy czym poziom lizozymu i laktoferyny zwiększono do poziomu występującego naturalnie w ludzkim mleku. Z innej strony uszkodzenie genu PrP metodami inżynierii genetycznej sprawiło, że tak zmodyfikowane owce stały się oporne na choroby prionowe.
I coś dla ekologów: możemy sprawić, że hodowla zwierząt gospodarskich stanie się przyjaźniejsza dla środowiska. Obecnie związki fosforu znajdujące się w przeciekających do gleby i wód gruntowych odchodach zwierzęcych prowadzą do zakwitu alg w zbiornikach wodnych i ich zarastania. Może temu zapobiec hodowla tzw. ‘enviropigs’, transgenicznych świni wyrażających w gruczołach ślinowych fytazę, enzym bakterii pałeczki okrężnicy, który jest w stanie zredukować zawartość związków fosforu w ich odchodach o 75%.
Co z bezpieczeństwem takich produktów dla człowieka? Czy może nastąpić horyzontalny transfer wprowadzonych genów między transgenicznymi zwierzętami a człowiekiem np. poprzez pośrednika jakimi są mikroorganizmy żyjące w układzie pokarmowym i glebie? Opublikowane w tym roku dane nad horyzontalnym transferem genów wykonane w Chinach przy ocenie bezpieczeństwa biologicznego wspomnianych powyżej krów mających ekspresję ludzkiego lizozymu i laktoferyny, wykazały brak tego typu horyzontalnego transferu genów, za pomocą metod o wysokiej czułości jakimi są reakcja PCR i real-time PCR. Koreluje to z innymi pracami analizującymi bezpieczeństwo biologiczne produktów GMO. Produkty te są więc bezpieczne w użyciu.
Jednakże nie jest to jedyna możliwość wykorzystania zwierząt genetycznie modyfikowanych. Możemy takie zwierzęta wykorzystać jako bioreaktory do produkcji biofarmaceutyków. Dlaczego wykorzystywać takie zwierzęta jeśli możemy wyprodukować leki w bakteriach, drożdżach, komórkach ssaczych czy owadzich, ostatecznie wyizolować z krwi? Hodowla komórkowa lub bakteryjna musi odbywać się w odpowiednim medium odżywczym, prawidłowo zbuforowanym, o właściwej temperaturze i wolnym od patogenów a na dodatek ciągle wymienianym. Jest to kosztowne. Są białka takie jak np. czynnik IX (lek w hemofilii B) lub białko C (lek przeciwkrzepliwy) wymagające modyfikacji poprzez gamma-karboksylację dla dostatecznej trwałości a taka modyfikacja zachodzi jedynie w komórkach ssaczych, czyli w najkosztowniejszym typie hodowli komórkowej. Problemem w hodowli komórkowej jest także produkcja dużych białek jak np. fibrynogenu (heksamer z 2 zestawów po 3 polipeptydy połączone 29 mostkami dwusiarczkowymi) z dostateczną wydajnością. Natomiast pozyskiwanie białek z ludzkiej surowicy krwi jest nie tylko niebezpieczne ze względu na patogeny (np. wirus HIV) ale nie pokrywa także potrzeb rynkowych. Początkowy wkład kapitałowy w wyprodukowanie zwierzęcia transgenicznego ostatecznie zwraca się w wyniku oszczędności w kosztach pozyskania biofarmaceutyku. W 2006 roku na rynek dopuszczony został pierwszy biofarmaceutyk będący produktem GMO czyli ATryn® - rekombinowana ludzka antytrombina (ATIII) produkowana przez transgeniczne kozy spod promotora dla beta-kazeiny w gruczole mlecznym. Szereg kolejnych biofarmaceutyków czeka na dopuszczenie na rynek jak np. fibrynogen, kolagen, alfa-1-antytrypsyna czy też ludzka hemoglobina produkowana we krwi transgenicznych świń.
Innym zastosowaniem są badania podstawowe analizujące funkcję danego genu czy fragmentu genomu. I tutaj jednym z najciekawszych przykładów z ostatnich lat jest tzw. „brainbow mouse”, mysz, która w wyniku modyfikacji genetycznej ma ekspresję różnych zestawów białek fluorescencyjnych w komórkach układu nerwowego. Pozwala to na uzyskanie olbrzymiego zróżnicowania kolorystycznego miedzy poszczególnymi neuronami i umożliwia dokładne prześledzenie procesu rozwoju układu nerwowego i formowania połączeń między neuronami.
Zastosowanie to wiąże się wprost z zastosowaniem modyfikacji genetycznej w celu uzyskania zwierzęcych modeli ludzkich chorób. Zwierzęta od dawna były organizmami modelowymi służącymi do analizy etiologii i patogenezy ludzkich chorób i zaburzeń. Jest to możliwe ze względu na pewne podobieństwa między organizmem człowieka a organizmami innych zwierząt co w przypadku niektórych zaburzeń pozwala na użycie zwierząt do badań i przeniesienia wyników na człowieka. Przykładem takiego schorzenia jest genetycznie warunkowana polidaktylia występująca zarówno u ludzi, jak u myszy czy kurczaka. Jednakże wiele występujących u człowieka schorzeń nie ma swoich odpowiedników wśród zwierząt i tutaj rozwiązaniem są transgeniczne organizmy modelowe. Przykładem takiego modelu może być mysi model zwłóknienia torbielowatego (mukowiscydozy). Zwierzęta takie pozwalają dopracować leki i metody terapii przed przystąpieniem do prób klinicznych na chorych pacjentach. Innym zastosowaniem jest np. zwiększenie częstotliwości zapadania na pewne schorzenia, tak by móc testować na nich leki. Przykładem jest pierwsza opatentowana mysz transgeniczna tzw. „oncomouse” lub „Harvard mouse” niosąca onkogen c-myc. Ma dzięki temu tendencję do formowania spontanicznych brodawczaków i jest używana do zarówno testowania leków przeciwnowotworowych jaki i karcinogenności pewnych leków i substancji. Obecnie modeli zwierzęcych służących do analizy karcinogenności czy genotoksyczności leków jest wiele. Jednakże zwierzęce modele chorób człowieka ciągle mają pewne ograniczenia – wyniki mogą zależeć od tła genetycznego zwierząt, środowiska, diety, zakażenia pewnymi patogenami. Jednakże nie można nie docenić wagi dobrze dobranego modelu zwierzęcego w leczeniu chorób człowieka.
Kolejnym zastosowaniem może być użycie inżynierii genetycznej do pozyskania odzwierzęcego źródła organów do transplantacji. Ksenotransplantacja organów od np. świni dałaby nam nielimitowane i przewidywalne źródło organów, możliwość starannego zaplanowania operacji, przedoperacyjnego traktowania dawcy lekami, możliwość analizy pod kątem zakażenia patogenami przed pobraniem organu. Jednakże ksenotransplantacja między człowiekiem a dalej spokrewnionymi z człowiekiem zwierzętami niż małpy człekokształtne jest, jak na razie, niemożliwa. Jest to przede wszystkim efekt nadostrego odrzucenia przeszczepu – reakcji związanej z układem dopełniacza, białkami znajdującymi się w naszej krwi i zdolnymi do utworzenia tzw. kompleksu atakującego błonę, który powoduje martwicę przeszczepionej tkanki w ciągu kilku minut od przeszczepu. Można oczywiście z krwioobiegu człowieka usunąć białka dopełniacza jednakże są to zwykle zbyt drastyczne metody dla osób oczekujących na przeszczep (np. użycie jadu kobry). Rozwiązaniem jest więc taka modyfikacja świni, by jej organy nie były odrzucane jako obce gatunkowo narządy. Częściowym rozwiązaniem zastosowanym przez firmę Imutran było wprowadzenie do genomu świń ludzkiego genu kodującego DAF (human decay accelerat ing factor), który jest w stanie rozłożyć białka dopełniacza i zredukować jego aktywność. Innym częściowym rozwiązaniem było usunięcie przez PPL Therapeutics genu alfa-1,3-galaktozylotransferazy świni co daje w efekcie brak antygenu Gal i brak reakcji przeciwciał biorących udział w jednej ze ścieżek aktywacji układu dopełniacza. Alternatywnym podejściem zastosowanym przez Instytut Zootechniki w Balicach było wprowadzenie genu alfa-l,2-fukozylotransferazy (transferazy H) człowieka, konkurującej z alfa-1,3-galaktozylotransferazą o ten sam substrat dając w efekcie obniżenie bariery immunologicznej wynikającej z nadostrego odrzucenia przeszczepu. Jednakże choć efekt działania dopełniacza na ksenotransplant został w ten sposób zminimalizowany, ciągle nie jest to efekt wystarczający do zastosowania ksenotransplantacji w klinice. Dodatkowym problemem może być także przeniesienie retrowirusów świni na człowieka.
Wszystkie metody opracowane do modyfikacji genetycznej zwierząt mogą także zostać wykorzystane w terapii genowej człowieka, która ciągle czeka na dopracowanie i eliminację efektów ubocznych. A także do wielu innych celów jak np. wyprodukowanie rybek – danio pręgowanego, świecących światłem fluorescencyjnym w wodzie zanieczyszczonej metalami ciężkimi i służących jako indykator zanieczyszczenia lub stabilnie świecących światłem fluorescencyjnym służących jako ozdobne rybki akwaryjne. Jak widzimy w genetycznej modyfikacji zwierząt drzemie olbrzymi potencjał, który zaczyna być wykorzystywany dopiero od ostatnich kilkunastu lat. Potencjału tego nie możemy lekceważyć, zwłaszcza przy ciągle wzrastającym zapotrzebowaniu ludzkości na lepsze zwierzęta hodowlane, tańsze i bardziej dostępne leki, nowe terapie, organy do przeszczepów i wiele innych zapotrzebowań obecnych i przyszłych, których rozwiązaniem może być jedynie kolejny krok w modyfikacji genetycznej zwierząt. Do obecnych otaczających nas ze wszystkich stron spontanicznych mutantów, selekcjonowanych przez tysiące lat dołączą zwierzęta transgeniczne ze starannie dopracowaną i sprawdzoną w laboratorium modyfikacją, oraz sprawdzonym poziomem bezpieczeństwa biologicznego.





