Gdański Uniwersytet Medyczny
strony wersji drukowanej: 16-21

Peptydy mogą wykazywać dwoistą naturę. Niektóre, konstruktywną (np. hormony peptydowe człowieka) inne zaś destruktywną (np. AMPs - ang. Antimicrobial Peptides) wobec drobnoustrojów. W związku z problemem narastającej oporności patogenów na konwencjonalne środki lecznicze, stale poszukuje się nowych rozwiązań. Jednym z obszarów poszukiwań są peptydy o działaniu przeciwdrobnoustrojowym, które znajdowane się w środowisku naturalnym. Organizm człowieka produkuje wiele peptydów o takowym działaniu, m.in. PR-39, histatyny, defensyny, dermicydyna, laktoferryna, lizozym czy też serprocydyny. Stanowią one o odporności nieswoistej organizmu, która jest efektem ich niespecyficznych mechanizmów działania. Często występującą właściwością AMPs jest ich dodatni ładunek wypadkowy będący konsekwencją obecności licznych reszt lizyny oraz argininy, przy jednocześnie rzadko występujących resztach kwasów - asparaginowego i glutaminowego. Oddziaływania z komórkami bakteryjnymi są wywołane siłami elektrostatycznymi, które przyczyniają się do zbliżenia odpowiednich peptydów do ujemnie naładowanej powierzchni komórki. Przyczyną wspomnianego ładunku powierzchni komórki bakteryjnej jest kwas tejchojowy (bakterie gram-dodatnie) i lipopolisacharydy - LPS (bakterie gram-ujemne). Komórki ludzkie nie posiadają zwykle ładunku powierzchniowego (wyjątkiem mogą być komórki nowotworowe), w związku z tym peptydy układu odpornościowego nie wykazują aktywności cytotoksycznej wobec organizmu. Obecność w cząsteczce peptydu zarówno fragmentów hydrofobowych jak i hydrofilowych umożliwia jednoczesne oddziaływanie z obszarami posiadającymi ładunek elektrostatyczny jak i z lipofilową częścią błony komórkowej. Opracowano kilka modeli wyjaśniających działanie przeciwdrobnoustrojowe peptydów. Są nimi model kanałowy (struktura klepek beczki, ang. Barrel-stave), dywanowy, kanałów pierścieniowych oraz agregacyjny. Przedstawiają one różne mechanizmy, których skutkiem jest permeabilizacja błony komórkowej prowadząca do zaburzenia integralności komórki, zachwiania równowagi jonowej (spadek potencjału błonowego) i energetycznej (wypływ ATP z komórki) oraz lizy osmotycznej. Ponadto niektóre z AMPs wpływają na ekspresję genów, zaburzają procesy transkrypcji i translacji. Peptydy o ujemnym ładunku wypadkowym wykazują odmienny sposób działania. Postuluje się, że po przeniknięciu w głąb komórki wywołują precypitację składników cytozolu (np. dermicydyna). Pozostałe organizmy także stosują linię obrony opartą na cząsteczkach peptydów. Za przykład niech posłużą owadzie defensyny i cekropiny, żabie magaininy (Xenopus laevis) czy też bakteriocyny (nizyna, Lactococcus lactis).
Ze względu na trudności w stosowaniu peptydów w terapii, poszukuje się alternatyw. β-peptydy jawią się jako jedna z nich. Są to cząsteczki zbudowane z β-aminokwasów, przy czym aminokwasy te mogą posiadać konfigurację β2, β3, β2,3 – co oznacza, że łańcuch boczny związany jest odpowiednio z węglem drugim, trzecim lub obydwoma (cząsteczki kwasu 3-aminopropionowego).
Występowanie β-aminokwasów w przyrodzie
Aminokwasy tego typu nie są szeroko rozpowszechnione w naturze, zaś głównym ich przedstawicielem jest β-alanina. Jest ona produktem katabolizmu pirymidyn, obok której powstaje także amoniak i dwutlenek węgla. Katabolizm tyminy i 5-metylocytozyny prowadzi do powstania β-aminoizomaślanu, który jest wydalany z organizmu. W przypadku cytozyny i uracylu powstaje wspomniana β-alanina, która może być wydalona lub włączona do syntezy mięśniowych dipeptydów – anseryny oraz karnozyny, a także do kwasu pantotenowego będącego komponentem koenzymu A. Ponadto β-alanina jest elementem antybiotyku lipopetydowego YM-170320, topostatyny będącej inhibitorem topoizomerazy I i II syntezowanej przez Thermonospora alba, pochodnych laktonów (najczęściej ugrupowania α-aminometylo-γ-butyrolaktonu) takich jak sinulaminy wyizolowane z Sinularia sp., Physarigin B – żółtego pigmentu wytwarzanego przez śluzowca Physarumrigidum, czy też alkaloidów takich jak β-stachydryna (alkaloid pirolidynowy) z krasnorostu Griffithsia flosculosa.
Otrzymywanie β-aminokwasów
Istnieje wiele metod otrzymywania omawianych aminokwasów na drodze syntezy chemicznej. Synteza Arndta-Eisterta jako substrat wykorzystuje odpowiedni α-aminokwas, którego konfiguracja absolutna na asymetrycznym atomie węgla zostaje zachowana w produkcie. W wyniku reakcji powstaje analogiczny β3-aminokwas. W pierwszej kolejności dochodzi do wytworzenia odpowiedniego chlorku kwasowego przy wykorzystaniu chlorku tionylu. W kolejnym etapie następuje atak nukleofilowy diazometanu na węgiel grupy karbonylowej z wydzieleniem chlorowodoru, co prowadzi do uzyskania odpowiedniego α-diazoketonu. Końcowym etapem jest przegrupowanie Wolffa, do którego dochodzi w obecności katalizatora (Ag+), fotochemicznie lub termicznie, przy udziale odpowiedniego odczynnika nukleofilowego. Obecność wody skutkuje powstaniem pożądanego β3-aminokwasu. Na ryc. 1 przedstawiono schemat omówionej reakcji. Reakcja homologacji estrów Kowalskiego jest kolejną z dróg prowadzących do otrzymania β-aminokwasów. Produktem pośrednim reakcji jest odpowiedni jon enolanowy, który otrzymywany jest poprzez działanie na substrat (ester aminokwasu) kolejno dibromometanem (źródło grupy metylenowej) i LiTMP (tetrametylopiperydyd litu), LiHMDS (bis[trimetylosililo]-amid litu), s-BuLi oraz n-BuLi. Poprzez działanie alkoholem w środowisku kwaśnym (np. MeOH w HCl) otrzymuje się właściwą dla użytego reagenta pochodną β-aminokwasu. Schemat reakcji Kowalskiego przedstawiono na ryc. 2. Podczas syntez istotne jest uwzględnienie kolejności wykonywanych działań, np. to czy grupa aminowa zostanie chroniona przed czy też po przekształceniu aminokwasu w β-homolog.
Otrzymywanie optycznie czynnych β2-aminokwasów może być zrealizowane na wiele sposobów, m.in. poprzez alkilację chiralnych, cyklicznych bądź acyklicznych enolanów, reakcje Mannicha obejmujące chiralne enolany, czy też katalizę metaliczną. Odpowiednią enancjoselektywność i wydajność zapewnia zastosowanie substancji pomocniczych w postaci oksazolidynonu. Schemat reakcji przedstawiono na ryc. 3.
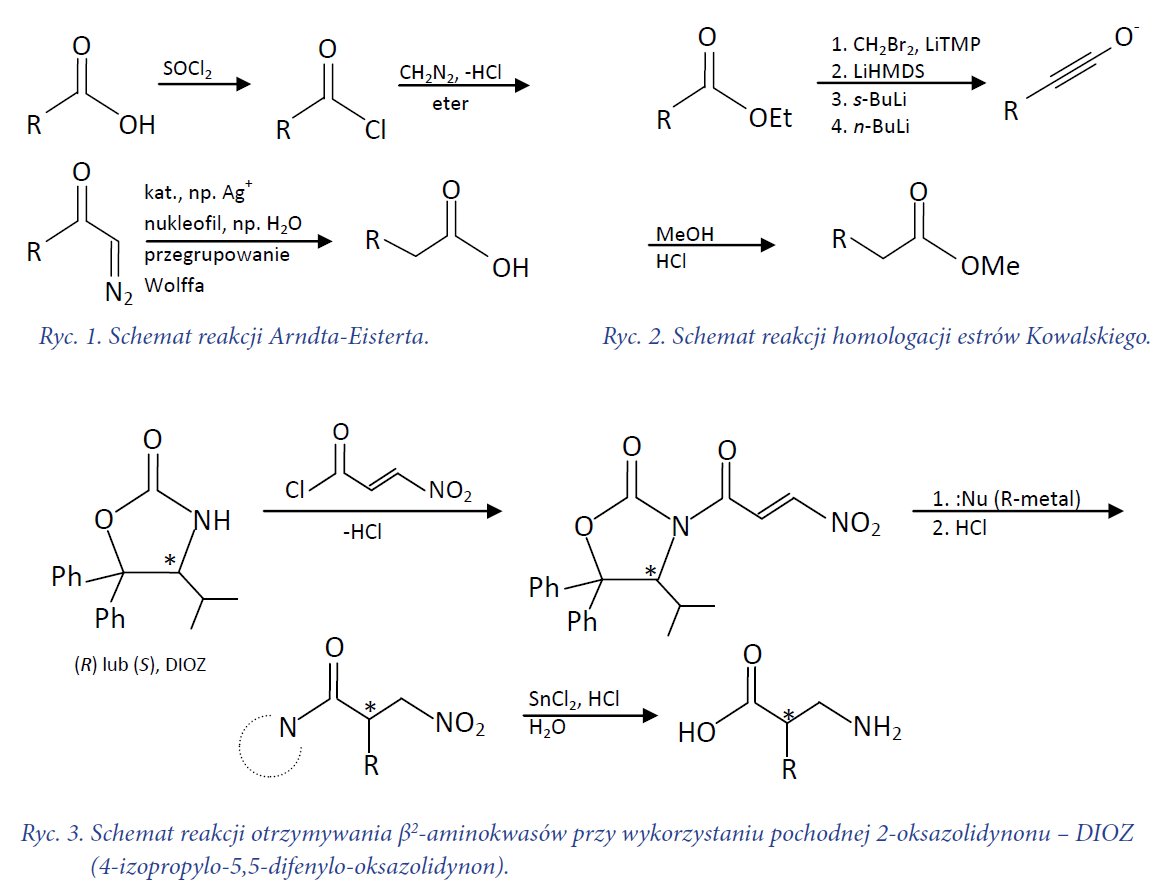
Zastosowanie odpowiedniego enancjomeru DIOZ pozwala na uzyskanie określonego diastereoizomeru, gdyż konfiguracja na węglu C4 oksazolidynonu ukierunkowuje przyłączenie podstawnika R, a tym samym wpływa na konfigurację absolutną na atomie C2 pożądanego aminokwasu.
Synteza β-peptydów
Stosowanymi metodami syntezy β-peptydów są głównie te przeprowadzane na nośniku stałym (np.
żywica Wanga) z zastosowaniem mikrofal jako elementu wspomagającego sprzęganie, zaś podejmowaną strategią syntezy jest ta wykorzystująca Fmoc (9-fluorenylometoksykarbonyl) do ochrony grup aminowych. Ich usuwanie odbywa się przy udziale zasady – piperydyny, zaś odszczepienie końcowego produktu od żywicy realizowane jest w środowisku kwaśnym – TFA (kwas trifluorooctowy). „Synteza mikrofalowa” jest szczególnie użyteczna zważywszy na fakt, że β-aminokwasy jako cząsteczki większe od aminokwasów „α” podczas syntezy na nośniku stałym tworzą dłuższe łańcuchy przy tej samej liczbie elementów składowych. Mikrofale wspomagają takową syntezę m.in. poprzez „rozprostowywanie” łańcuchów peptydowych ułatwiając w ten sposób przyłączanie kolejnych aminokwasów (zwiększenie dostępności grup biorących udział w sprzęganiu). Poszczególne kroki syntezy nie odbiegają metodycznie od tych stosowanych dla standardowych peptydów.
β-analogi strukturalne
Przyczyny badania β-peptydów nie ograniczają się bynajmniej do chęci poznania tworzonych przezeń struktur II-rzędowych. Motywem mogą być także poszukiwania cząstek o określonej aktywności biologicznej takiej jak aktywność przeciwdrobnoustrojowa, przeciwwirusowa, przeciwpasożytnicza, przeciwnowotworowa, cytotoksyczna, hemolityczna czy też modyfikująca ekspresję genów. W celu otrzymania aktywnych produktów stosowane jest podejście oparte na prostym odwzorowaniu sekwencji aminokwasowej „w języku” β-aminokwasów. Ponadto mimetyka może polegać na naśladownictwie strukturalnym peptydów. W przypadku AMPs byłoby to odtworzenie struktur heliakalnych z odpowiednio rozdystrybuowanymi resztami posiadającymi ładunek elektrostatyczny z jednoczesnym zachowaniem amfifilowego charakteru cząstki.
Ze względu na obecność „dodatkowej” grupy metylenowej w β-aminokwasach, w rozważaniach strukturalnych należy uwzględnić kąt θ definiowany jako kąt dwuścienny pomiędzy kolejnymi atomami C1 (karbonylowy), C2, C3 oraz N. W związku z tym reprezentacja graficzna odpowiadająca ideowo wykresowi Ra-machandrana w przypadku β-peptydów opisana byłaby w przestrzeni trójwymiarowej. By β-peptyd wykazywał helikalną strukturę II-rzędową wymagana jest konformacja „gauche” dla tego kąta torsyjnego. Struktura ta może być stabilizowana obecnością odpowiednich cyklicznych β-aminokwasów, takich jak kwasy trans-2-aminocykloheksanokarboksylowy (ACHC), trans-2,5-diaminocykloheksnokarboksylowy (DCHC), trans-2-aminocyklopentanokarboksylowy (ACPC), trans-3-amino-pirolidynokarboksylowy (APC). Konfiguracja cis powyższych kwasów nie zapewnia struktury helikalnej. β-Ala nie wykazuje preferencji co do kąta θ, ponieważ nie zawiera łańcuchów bocznych związanych z atomami C2 czy też C3. Jest w związku z tym bardziej labilna strukturalnie. Obecność podstawników w pozycjach C2 i/lub C3 predestynuje do występowania konformacji synklinalnej. W przypadku β2,3 aminokwasu od poszczególnych układów konfiguracji na atomach C2 oraz C3 uzależniona jest przyjęta konformacja (gauche bądź antyperiplanarna). Konformacja gauche jest uprzywilejowana ze względu na oddziaływania pomiędzy różnoimiennymi ładunkami cząstkowymi na atomach azotu i węgla karbonylowego. Zaobserwowano, że helisy tworzone są w przypadku β-peptydów znacznie łatwiej niż ma to miejsce u α-peptydów, tzn. minimalna ilość aminokwasów niezbędnych do realizacji danej struktury jest mniejsza.
β-Peptydy, podobnie jak te z rodziny „α”, tworzą struktury II-rzędowe w różnej formie. W obrębie helis rozróżnia się m.in. helisy typu 8, 10, 12, 14 oraz 10/12. Poszczególne wartości oznaczają najmniejszą liczbę atomów połączonych wiązaniami kowalencyjnymi znajdujących się pomiędzy indywiduami chemicznymi współtworzącymi wiązanie wodorowe wewnątrz łańcucha szkieletowego peptydu. Na ryc.4. przedstawiono helisę 10/12, jako przykład obrazujący powyższą definicję.
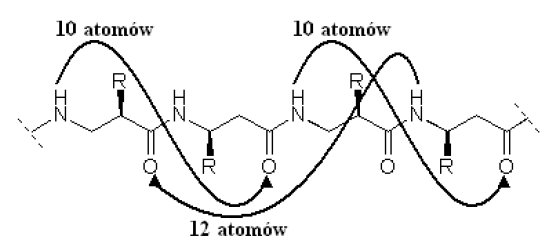
Ryc. 4. Helisa 10/12.
Promień (Å) oraz liczba aminokwasów przypadająca na jeden skręt helisy typu 12 i 14 wynoszą odpowiednio 2,3 i 2,5 oraz 2,7 i 3,0. Dla helisy α są to wartości 2,2 i 3,6. W helisie-14 (dokładniej 314) łańcuchy boczne aminokwasów usytuowane są nieomal jeden nad drugim, przy czym zgodnie z przytoczonymi powyżej danymi są to łańcuchy co trzeciego aminokwasu. Rzutując obraz cząstki na płaszczyznę prostopadłą do osi helisy otrzymuje się trzy skupienia takowych łańcuchów, zaś kąty między nimi wynoszą ok. 120°. Jedną z możliwych do realizacji struktur przestrzennych β-peptydów jest nanorurka zbudowana z elementów cyklicznych. Oddziaływania utrzymujące cykliczne β-peptydy, jeden nad drugim oparte mogą być m.in. na oddziaływaniach π-π pomiędzy ugrupowaniami aromatycznymi, takimi jak pierścienie imidazolowe, fenylowe czy układ indolu oraz ich pochodne, czy też przy udziale ładunku elektrostatycznego (anion/kation-π). Elementy nanorurki powinny być względem siebie komplementarne, tj. posiadać odpowiadające sobie ładunki w każdej z warstw. Utworzenie nanorurki wewnątrz błony lipidowej doprowadziłoby do powstania kanału umożliwiającego wypływ jonów, spadek potencjału błonowego i śmierci komórki. Wielkość peptydu cyklicznego znajduje bezpośrednie przełożenie na średnicę tworzonych porów, toteż manipulując tym parametrem doprowadzić można do wypływu większych cząsteczek, takich jak glukoza czy ATP.
Perspektywy
Niebagatelną zaletą w kontekście terapeutycznym obniżona wrażliwość β-peptydów na działanie
enzymów proteolitycznych, w tym ssaczych, pochodzących od mikroorganizmów i drożdżaków. Zbadano, że kolonie drobnoustrojów bardzo powoli degradują tego typu peptydy. Istnieją także badania wskazujące na brak lub ich niską aktywność cytotoksyczną i hemolityczną. Oczywistą konsekwencją powyższych właściwości jest przypuszczenie o możliwości otrzymania takich peptydomimetyków, które podane będą drogą enteralną. Tego typu aplikacja leku jest preferowana przez większość pacjentów. Problematycznymi aspektami wciąż pozostanie niskie pH oraz fizyczna bariera ścian jelita. Zestawiając istotność występowania struktury helikalnej dla aktywności przeciwdrobnoustrojowej z łatwością jej tworzenia przez β-peptydy w środowisku lipidów błonowych, można domniemać o istnieniu niewielkich cząstek helikalnych β-peptydów o niskiej immunogenności, zadowalającej biodostępności i aktywności biologicznej. Innym wykorzystaniem owych peptydów jest funkcjonalizacja powierzchni materiałów stosowanych w medycynie, np. cewników. Zbadano, że tego typu aplikacja skutecznie obniżapotencjał kolonizacji danej niszy, w tym możliwość utworzenia biofilmu. Powszechne zastosowanie tego rozwiązania mogłoby przyczynić się do redukcji częstości występowania zakażeń szpitalnych związanych ze stosowanymi cewnikami, drenami czy też kaniulami. β-Peptydy, jako obiecująca grupa związków, wciąż czekają na odkrycie skrywanego potencjału i odnalezienie właściwej dla nich aplikacji.
Literatura:
Beke T., Somlai C., Perczel A., „To-ward a rational design of β-peptide structures”, J. Comput. Chem., 2006, 27: 20-38
Cheng R.P., Gellman S.H., DeGrado W.F., „β-peptides: From structure to function”, Chem. Rev., 2001, 101: 3219-3232
Cytryńska M., „Will antimicrobial peptides replace antibiotics?”, Zakażenia, 2013, 2: 12-17
Gray D., Concellón C., Gallagher T., „Kowalski Ester Homologation. Ap-plication to the Synthesis of β-Amino Esters”, J. Org. Chem., 2004, 69: 4849-4851
Raman N., Lee M-R, Palecek S.P., Lynn D.M., „Polymer multilayers loaded with antifungal β-peptides kill planktonic Candida albicans and reduce formation of fungal biofilms on the surfaces of flexible catheter tubes”, J. Control. Release, 2014, http://dx.doi.org/10.1016/j.jconrel.2014.05.026
Seebach D., Gardiner J., „β-peptidicpeptidomimetics”, Acc. Chem. Res., 2008, 41(10): 1366-1375





