Agnieszka Feliczak-Guzik, Magdalena Górzyńska, Aleksandra Zielińska, Agata Wawrzyńczak
Uniwersytet im. Adama Mickiewicza w Poznaniu, Wydział Chemii
strony wersji drukowanej: 52-60

Zainteresowanie promieniowaniem mikrofalowym nieustannie wzrasta ze względu na szeroki wachlarz jego zastosowań oraz poszukiwanie coraz to nowych metod aktywacji reakcji chemicznych. Do jego głównych zalet należy przede wszystkim możliwość szybkiego ogrzewania próbki, zastosowania w syntezach organicznych, jak i nieorganicznych, przeprowadzenia ekstrakcji wspomaganej mikrofalami lub procesu roztwarzania, przy jednoczesnym obniżeniu zarówno kosztów, jak i czasu trwania procesów technologicznych [1].
strony wersji drukowanej: 52-60

Zainteresowanie promieniowaniem mikrofalowym nieustannie wzrasta ze względu na szeroki wachlarz jego zastosowań oraz poszukiwanie coraz to nowych metod aktywacji reakcji chemicznych. Do jego głównych zalet należy przede wszystkim możliwość szybkiego ogrzewania próbki, zastosowania w syntezach organicznych, jak i nieorganicznych, przeprowadzenia ekstrakcji wspomaganej mikrofalami lub procesu roztwarzania, przy jednoczesnym obniżeniu zarówno kosztów, jak i czasu trwania procesów technologicznych [1].
PROMIENIOWANIE MIKROFALOWE
Promieniowanie mikrofalowe to promieniowanie elektromagnetyczne, występujące pomiędzy promieniowaniem podczerwonym a falami ultrakrótkimi, o długości fali od 1m do 1cm, co odpowiada częstotliwości od 0,3 do 300 GHz. Biorąc pod uwagę fakt częstego wykorzystywania promieniowania mikrofalowego w telekomunikacji, poszczególne jego częstości przypisano określonym dziedzinom, np. dla kuchenek mikrofalowych i sprzętu stosowanego w laboratorium przydzielono częstotliwość 2,45 GHz (λ= 12,24cm) [2].
MECHANIZMY OGRZEWANIA MIKROFALOWEGO
Wspomaganie syntez/reakcji chemicznych promieniowaniem mikrofalowym polega głównie na „mikrofalowym ogrzewaniu dielektrycznym”, które wynika ze zdolności danego reagenta do pochłaniania energii przyporządkowanej promieniowaniu mikrofalowemu oraz jej zamianie na energię cieplną. Ogrzewanie to, spowodowane poprzez składową elektryczną promieniowania elektromagnetycznego, może występować na dwa sposoby: poprzez rotację cząsteczek dipolowych i przewodnictwa jonowego.
W ogrzewaniu bazującym na rotacji dipoli cząsteczki będące dipolami próbują ustawić się zgodnie z kierunkiem i zwrotem zmiennego pola elektromagnetycznego, dzięki czemu się poruszają. Podczas rotacji energia promieniowania mikrofalowego zamieniana jest na energię kinetyczną, którą przekazują sobie zderzające się cząsteczki. Skutkuje to równomiernym rozprzestrzenianiem się ciepła w ogrzewanym materiale. Drugi mechanizm opiera się na przewodnictwie jonowym. Obecne w materiale jony poruszają się zgodnie z kierunkiem zmiennego pola elektrycznego. Aniony przesuwają się w kierunku anody, natomiast kationy w kierunku katody. Zderzanie się migrujących jonów z jonami poruszającymi się w przeciwnym kierunku, wywołuje efekt cieplny, który jest tym większy im większe jest stężenie i ruchliwość jonów [3-4].
PORÓWNANIE OGRZEWANIA TRADYCYJNEGO Z MIKROFALOWYM
Podczas konwencjonalnego ogrzewania zewnętrzne źródło ciepła musi ogrzać ścianki naczynia a dopiero później rozpuszczalnik i reagenty [3]. Minusem tradycyjnego ogrzewania próbki jest długi czas nagrzewania, który zależy od przewodnictwa temperaturowego zastosowanego naczynia oraz nierównomierny rozkład temperatury w naczyniu reakcyjnym. Wadą tej metody jest również ograniczona kontrola reakcji oraz trudności wiążące się z chłodzeniem próbki. W przeciwieństwie do opisanej metody, ogrzewanie mikrofalowe umożliwia szybki wzrost temperatury reagentów, gdyż nagrzewanie nie zależy od przewodnictwa termicznego naczynia, ponadto w łatwy sposób można kontrolować reakcję, a po wyłączeniu źródła promieniowania pozostaje tylko wtórne ciepło [5-7]. Oprócz tego zastosowanie mikrofali ogranicza lub wręcz eliminuje obecność szkodliwych rozpuszczalników, co przynosi wiele korzyści dla środowiska. Zwiększa się również selektywność i czystość wytwarzanych produktów. Niebagatelny wpływ na popularność tej metody ma zmniejszenie kosztów procesu technologicznego ze względu
na to, że cały proces zostaje znacznie skrócony. Przyczyną tak dużego zwiększenia szybkości reakcji jest możliwość rozgrzania rozpuszczalników powyżej ich temperatury wrzenia oraz istnienie tzw. „gorących miejsc”, w których temperatura może być wyższa nawet o 70°C. Zajęcie już 2% objętości mieszaniny przez te „przegrzane reaktorki” umożliwia kilkukrotne zwiększenie szybkości reakcji [3-4].
ZASTOSOWANIE PROMIENIOWANIA MIKROFALOWEGO
Promieniowanie mikrofalowe znalazło szerokie zastosowanie m.in. w szybkim podgrzewaniu, ekstrakcji i zatężaniu próbek, spopielaniu i stapianiu materiałów, mineralizacji, roztwarzaniu i suszeniu próbek, renowacji budynków, oznaczaniu zawartości wody, utrwalaniu próbek materiałów biologicznych, termicznej utylizacji odpadów, odkażaniu materiałów biologicznych, nawigacji, bezprzewodowej sieci komputerowej, łączności satelitarnej, kuchenkach mikrofalowych, itd. [4].
Poniżej opisano zastosowanie promieniowania mikrofalowego w procesie ekstrakcji olejków eterycznych, tłuszczów, składników kosmetyków oraz jego potencjalne wykorzystanie w medycynie i fizjologii.
Ekstrakcja mikrofalowa olejków eterycznych
Popyt na produkty naturalne ze strony przemysłu farmaceutycznego i kosmetycznego zaowocował poszukiwaniem efektywnych metod pozyskiwania substancji występujących w surowcach w niewielkiej ilości np. olejków eterycznych. Olejki eteryczne, stanowiące najważniejszą oraz najliczniejszą grupę składników kompozycji zapachowych, otrzymywane są z surowców roślinnych, takich jak: kwiaty, liście, korzenie, ziele, owoce, gałązki głównie poprzez: destylację z parą wodną, wytłaczanie oraz ekstrakcję dwutlenkiem węgla w stanie nadkrytycznym [8]. W chwili obecnej coraz większym zainteresowaniem w pozyskiwaniu olejków eterycznych cieszą się metody bazujące na wykorzystaniu promieniowania mikrofalowego. Metody te zostaną opisane poniżej.
Destylacja mikrofalowa sprężonym powietrzem (CAMD)
Destylacja mikrofalowa sprężonym powietrzem (CAMD)
Proces ten, zaproponowany w 1989 roku przez Craveiro i współpracowników [9], został uznany za pierwszą mikrofalową technikę ekstrakcji olejków eterycznych z roślin aromatycznych oraz przypraw. Aparatura wykorzystywana w tej technice składa się z trzech zasadniczych części: kompresora powietrza, pieca mikrofalowego oraz systemu chłodzącego.
Technika ta polega na wykorzystaniu sprężonego powietrza zamiast pary wodnej w celu wyodrębnienia pożądanego olejku. Sprężone powietrze jest wtryskiwane w sposób ciągły do reaktora mikrofalowego, w którym znajduje się matryca (surowiec) zanurzona w wodzie i ogrzewana przy użyciu mikrofal. Następnie para zostaje nasycona lotnymi cząsteczkami i doprowadzona do odbieralnika zanurzonego w układzie chłodzącym znajdującym się na zewnątrz pieca mikrofalowego. Już po kilku minutach woda oraz aromatyczne cząsteczki olejku zostają skroplone i odzyskane w ilościach zbliżonych do ilości olejku uzyskiwanego tradycyjnymi metodami.
W 2010 roku Lee opatentował podobny system wykorzystywany w ekstrakcji olejków eterycznych: “Urządzenia mikrofalowe oraz metody ekstrakcji olejków eterycznych, esencji oraz pigmentów w przepływie gazu” [10]. Temperatura skraplacza wykorzystywanego w celu chłodzenia gazu wypływającego z pojemników do ekstrakcji mieści się w przedziale między -20 °C a -15 °C.
Hydrodestylacja mikrofalowa (MWHD)
Proces mikrofalowej hydrodestylacji (MWHD), opracowany w 2004 roku przez Stashenko i współpracowników, opiera się na klasycznej hydrodestylacji; jedynie część linii produkcyjnej procesu hydrodestylacji umieszcza się w piecu mikrofalowym [11]. Matryca (surowiec) jest podłączona razem z wodą do reaktora mikrofalowego znajdującego się wewnątrz pieca mikrofalowego. System chłodzący oraz odbieralnik znajdują się na zewnątrz tegoż pieca mikrofalowego. Technika ta znalazła zastosowanie w ekstrakcji olejków eterycznych z wielu aromatycznych roślin i przypraw [12-15].
W 2006 roku Flamini i współpracownicy udoskonali w/w metodę [16], wprowadzając izolowaną, koncentryczną, mikrofalową antenę wewnątrz szklanej kolby zawierającej matrycę (surowiec) oraz wodę. Tego typu ogrzewanie mikrofalowe jest bezpieczne oraz oszczędne zarówno pod względem czasu, jak i energii, przez co wykorzystywane jest w przemyśle.
Kolejna innowacyjna, mikrofalowa destylacja z parą wodną (MSD), została opracowana w 2008 roku przez Chemata i współpracowników [17]. Proces ten bazuje na tradycyjnej destylacji z parą wodną, natomiast promieniowanie mikrofalowe wykorzystywane jest tylko w reaktorze ekstrakcyjnym. System chłodzący oraz odbieralnik znajdują się na zewnątrz pieca. Metoda ta jest stosowana do ekstrakcji między innymi olejku eterycznego z kwiatu lawendy (L. angustifolia Mill.).
Bezrozpuszczalnikowa ekstrakcja mikrofalowa (SFME)
Bezrozpuszczalnikowa ekstrakcja mikrofalowa została opracowana i opatentowana w 2004 r. przez Chemata i współpracowników [18-19]. SFME jest jedną z najnowszych technik ekstrakcyjnych olejków eterycznych wspomaganych promieniowaniem mikrofalowym, bez udziału rozpuszczalnika oraz wody pod ciśnieniem atmosferycznym. Metoda ta bazuje na procesie suchej destylacji, która dodatkowo wspomagana jest promieniowaniem mikrofalowym. W reaktorze mikrofalowym umieszcza się matrycę (surowiec), bez dodatku wody lub rozpuszczalnika organicznego. Pod wpływem tego promieniowania następuje ogrzewanie wody zgromadzonej w surowcu, co umożliwia przerwanie gruczołów zawierających olejek eteryczny. W tym etapie procesu dochodzi do uwolnienia olejku, który następnie unoszony jest z parą otrzymywaną w wyniku wcześniejszego ogrzewania wody znajdującej się w matrycy. System chłodzący, umieszczony na zewnątrz pieca mikrofalowego, umożliwia ciągłą kondensację destylatu, złożonego z wody oraz olejku eterycznego. Metoda ta znalazła zastosowanie do pozyskiwania olejków zarówno ze świeżych, jak i suchych roślin, przypraw, aromatycznych ziół oraz owoców cytrusowych [20-23].
Zmodyfikowaną ekstrakcję bezrozpuszczalnikową wspomaganą promieniowaniem mikrofalowym zaproponował Wang wspólnie ze współpracownikami w 2006 roku [24]. Udoskonalenie tej metody polegało na dodaniu do surowca karbonylku żelaza. Kuliste cząsteczki tegoż związku miały za zadanie pochłanianie części emitowanego promieniowania mikrofalowego i odzyskiwanie go w środku reaktora mikrofalowego w postaci ciepła, co umożliwia ogrzewanie surowca bez dostarczania dodatkowej energii. Promieniowanie mikrofalowe może być również pochłaniane przez takie związki, jak: grafit, węgiel aktywny oraz ciecze jonowe [25-26].
Ekstrakcja mikrofalowa tłuszczów
Wśród materiałów, z których ekstrahować można surowce tłuszczowe do potencjalnego wykorzystania w przemyśle kosmetycznym, wyróżnia się zarówno te pochodzenia roślinnego, jak i zwierzęcego. Oleje roślinne pozyskuje się m.in. z orzechów, migdałów, owoców (oliwki) oraz nasion roślin oleistych, np. słonecznika, soi, kukurydzy, a nawet bawełny. Ponadto w przemyśle kosmetycznym wykorzystywane są również stałe tłuszcze roślinne, takie jak: masło kakaowe lub palmowe oraz tłuszcz kokosowy, jednak sposoby ich pozyskiwania wymagają bardziej złożonych procedur. Tłuszcze pochodzenia zwierzęcego, ekstrahowane w celu wykorzystania ich w przemyśle kosmetycznym, stanowią obecnie zdecydowaną mniejszość [27].
Konwencjonalne techniki ekstrakcji surowców tłuszczowych w skali laboratoryjnej bazują zarówno na procesach ekstrakcji rozpuszczalnikowej poprzedzanej hydrolizą (kwasową, zasadową lub enzymatyczną), jak również na bezpośredniej ekstrakcji z surowców. Pomimo ciągłych prób usprawnienia, nadal wiążą się one z długotrwałym procesem wstępnej obróbki surowców oraz bardzo często z wielokrotnym powtarzaniem procesu ekstrakcji w celu uzyskania zadowalających wydajności produktów [27].
Współcześnie coraz częściej odchodzi się od konwencjonalnych metod pozyskiwania substancji tłuszczowych na rzecz bardziej nowoczesnych technik. . Zalicza się do nich m.in. ekstrakcję cieczami w stanie nadkrytycznym, ekstrakcję wspomaganą ultradźwiękami ultradźwiękami lub mikrofalowym. Ostatnia z wymienionych metod znajduje coraz szersze zastosowanie w procesie otrzymywania surowców tłuszczowych na potrzeby przemysłu kosmetycznego.
W przypadku procesu ekstrakcji wspomaganego promieniowaniem mikrofalowym (MAE – ang. Microwave-assisted Extraction) niezwykle istotną kwestią jest właściwy dobór czynnika ekstrahującego. Ekstrahent powinien przede wszystkim posiadać zdolność absorbowania i propagacji mikrofal, a jednocześnie móc oddziaływać z surowcem poddawanym procesowi ekstrakcji oraz dobrze rozpuszczać substancje ekstrahowane. Czynnik ekstrahujący lipidy z tkanek roślinnych lub zwierzęcych powinien cechować się odpowiednią polarnością, która zapewni ekstrakcję zarówno substancji tłuszczowych o charakterze neutralnym, jak i tych bardziej polarnych, związanych z błonami komórkowymi. Ponadto polarny charakter ekstrahentu pozwala na efektywne przeprowadzenie procesu ekstrakcji z próbek zawierających dużą ilość wody. Dlatego też w przypadku substancji tłuszczowych najczęściej stosowanym w procesie MAE układem rozpuszczalników jest mieszanina acetonu oraz n-heksanu [28]. W ostatnim czasie pojawiły się również doniesienia literaturowe dotyczące wykorzystywania mieszaniny octanu etylu i cykloheksanu jako wydajnego ekstrahentu w procesie pozyskiwania substancji tłuszczowych poprzez ekstrakcję wspomaganą mikrofalowo [29]. W przypadku MAE ważnym aspektem jest również to, aby proces pozyskiwania substancji tłuszczowych był w jak największym stopniu prowadzony w zgodzie z zasadami zielonej chemii. Stąd też coraz częściej prowadzone są badania nad zastąpieniem niektórych rozpuszczalników ich bardziej ekologicznymi odpowiednikami, np. limonen, będący głównym produktem przeróbki owoców cytrusowych, okazał się być doskonałym zamiennikiem n-heksanu w procesie mikrofalowej ekstrakcji oleju z pestek oliwek [30].
W procesie pozyskiwania w skali laboratoryjnej składników tłuszczowych metodą MAE wykorzystuje się obecnie szeroką gamę aparatury, począwszy od „domowych” kuchenek mikrofalowych, poprzez zestawy laboratoryjne przygotowywane we własnym zakresie, a skończywszy na komercyjnych układach tworzonych specjalnie do tego celu, np. firmy CEM. Dostępne obecnie na rynku gotowe reaktory mikrofalowe pozwalają na jednoczesne operowanie wieloma próbkami oraz umożliwiają kontrolę ciśnienia oraz temperatury procesu ekstrakcji. Istnieje również możliwość wspierania promieniowaniem mikrofalowym tradycyjnych układów ekstrakcyjnych stosowanych w procesie otrzymywania substancji tłuszczowych. Bazując na tej zasadzie wprowadzono do użytku laboratoryjnego technikę MASE (ang. Microwave-assisted Soxhlet Extraction), która łączy w sobie zalety konwencjonalnej ekstrakcji w aparacie Soxhleta, omijając jednocześnie jej niedogodności, związane z przepustowością oraz zdolnością do ilościowej ekstrakcji składników tłuszczowych silniej związanych w surowcu [27]. Podstawową różnicę między komercyjnie dostępnymi układami ekstrakcyjnymi, działającymi w obecności promieniowania mikrofalowego, a wspieranymi mikrofalowo tradycyjnymi systemami ekstrakcji stanowi fakt, iż w przypadku układów komercyjnych cała procedura ekstrakcji odbywa się w systemie zamkniętym. Dzięki temu proces izolowania składników tłuszczowych zajmuje mniej czasu, a maksymalna temperatura procesu nie jest tak bardzo uzależniona od temperatury wrzenia czynnika ekstrahującego, jak ma to miejsce w układzie otwartym. Z kolei otwarte układy ekstrakcyjne takie jak np. MASE nadają się do pozyskiwania bardziej termolabilnych substancji tłuszczowych. W procesie ekstrakcji składników tłuszczowych na skalę laboratoryjną wykorzystywane są również kuchenki mikrofalowe przeznaczone do użytku „domowego”, które pracują przy stałej częstotliwości 2,45 GHz i dostarczają do próbki promieniowanie o mocy 700-1200 W. Ich podstawową wadą jest jednak przede wszystkim brak możliwości precyzyjnego kontrolowania parametrów procesu ekstrakcji, a co za tym idzie, składu otrzymanego ekstraktu [31].
Zdarza się dość często, że technika MAE konfrontowana jest z konwencjonalnymi technikami ekstrakcji, jak również z metodami ekstrakcji składników tłuszczowych, w których wykorzystuje się inne typy wspomagania tego procesu (ultradźwięki, rozpuszczalniki w stanie nadkrytycznym). Porównując rezultaty ekstrakcji prowadzonych tak różnymi metodami należy jednak wystrzegać się zestawiania wyników uzyskanych przy pomocy zaawansowanej aparatury oferowanej przez autoryzowanych producentów sprzętu wykorzystującego promieniowanie mikrofalowe z rezultatami otrzymanymi przy użyciu układów konstruowanych samodzielnie w laboratorium [27].
Porównanie techniki MAE z jej odpowiednikiem wykorzystującym wspomaganie ultradźwiękami (USAE – ang. Ultrasound-assisted Extraction) wykazało, iż obie te procedury pozwalają otrzymać zbliżone rezultaty w procesie ekstrakcji składników tłuszczowych, a w przypadku substancji o wyższej termolabilności technika USAE okazała się być nawet bardziej przydatna [32, 33]. Z kolei MAE wydaje się być zdecydowanie lepszym wyborem dla ekstrakcji substancji termicznie stabilnych, kiedy wzrost temperatury procesu pozwala uzyskać zdecydowanie lepszą wydajność ekstraktu. Zalety obu tych technik zostały wykorzystane w tzw. procesie UMAE (ang. Ultrasound and Microwaves for Acceleration of Extraction). Na skalę laboratoryjną UMAE z powodzeniem zostało już wykorzystane do ekstrakcji wielu związków czynnych, m.in. olejów z różnych surowców roślinnych, pozwalając uzyskiwać w krótszym czasie ekstrakty z większą wydajnością i o lepszej czystości niż miało to miejsce w przypadku klasycznych metod ekstrakcji [34].
Zestawienie techniki MAE z jedną z konwencjonalnych metod ekstrakcji substancji tłuszczowych (tzw. ekstrakcją Bligha-Dyera) wykazało, iż obie procedury cechują się wysoką powtarzalnością, jednak MAE wykorzystuje mniejsze ilości surowców oraz rozpuszczalników. Ponadto rozpuszczalniki stosowane w MAE zalicza się do chemikaliów mniej obciążających środowisko naturalne, przez co proces ten uchodzić może za bardziej „zielony”. Niewątpliwą zaletą MAE okazało się również to, że czas potrzebny do uzyskania zbliżonych wydajności ekstraktu był zdecydowanie krótszy niż w przypadku techniki konwencjonalnej, a dodatkowo możliwe było ekstrahowanie jednocześnie kilku próbek. Należy również podkreślić, iż w przeciwieństwie do metody Bligha-Dyera zawartość wody w surowcach poddawanych ekstrakcji MAE nie wpływała w sposób istotny na jakość otrzymywanego ekstraktu [27].
Z kolei konfrontacja MAE z technikami ekstrakcji wykorzystującymi rozpuszczalniki pracujące pod zwiększonym ciśnieniem i/lub w temperaturze poniżej ich punktu krytycznego (SHLE – ang. Superheated Liquid Extraction), pozwoliła na stwierdzenie, iż drastyczniejsze warunki panujące podczas SHLE prowadzą do bardziej zanieczyszczonych ekstraktów, których oczyszczanie sprawia, że technika ta staje się bardziej czasochłonna i wymaga dodatkowego dostarczania energii. Dodatkowo MAE umożliwia bezpośrednią ekstrakcję składników tłuszczowych nawet z silnie wilgotnych surowców, podczas gdy użycie SHLE wymaga uprzedniego osuszania próbki. Podstawową wadą MAE w porównaniu z SHLE jest konieczność oddzielania ekstraktu od pozostałości surowca po zakończonym procesie ekstrakcji [35].
Ekstrakcja mikrofalowa składników tłuszczowych prowadzona w skali laboratoryjnej ma na celu przede wszystkim poprawę efektywności procesu względem tzw. konwencjonalnych metod ekstrakcji oraz opracowanie skutecznej metody pozyskiwania specyficznej grupy składników tłuszczowych lub wykorzystania w tym celu nowych surowców. MAE prowadzona w skali laboratoryjnej może posłużyć również jako prekursor prowadzenia danej techniki ekstrakcji surowców tłuszczowych na skalę przemysłową.
Pomimo wielu niewątpliwych zalet towarzyszących mikrofalowej ekstrakcji składników tłuszczowych, technika ta posiada również pewne wady. Problemem jest m.in. konieczność długotrwałego chłodzenia układu po zakończonym procesie w celu zminimalizowania ryzyka utraty bardziej lotnych składników ekstraktu. Ponadto temperatura wewnątrz naczynia reakcyjnego może wzrosnąć w sposób niekontrolowany, powodując przejście bardziej lotnych produktów do fazy gazowej znajdującej się nad właściwym ekstraktem. W przypadku zastosowania MAE należy także liczyć się z dość niską selektywnością ekstraktu. Ze względu na duże zdolności ekstrakcyjne rozpuszczalników i samej techniki MAE, pozyskanie pożądanego produktu może wiązać się z koniecznością zastosowania dodatkowego procesu separacji i/lub oczyszczania. Konieczne jest również zastosowanie filtracji lub odwirowywania próbek po zakończeniu ekstrakcji w celu oddzielenia ekstraktu od stałych pozostałości materiałów roślinnych [27].
Współcześnie obowiązujące trendy w optymalizacji techniki MAE obejmują przede wszystkim możliwość stosowania coraz bardziej przyjaznych środowiskowo rozpuszczalników oraz opracowania bardziej wydajnych magnetronów, które pozwoliły podwyższyć efektywność samego procesu ekstrakcji, a jednocześnie obniżyłyby koszty wprowadzania MAE do zastosowań na skalę przemysłową. Dzięki temu ekstrakcja wspomagana mikrofalami mogłaby znaleźć powszechne zastosowanie nie tylko w przemysłowych procesach pozyskiwania wysokowartościowych chemikaliów na potrzeby przemysłu kosmetycznego lub farmaceutycznego, ale również w otrzymywaniu tłuszczów jadalnych dla przemysłu spożywczego [27].
Techniki mikrofalowej ekstrakcji składników znajdujących się w kosmetykach
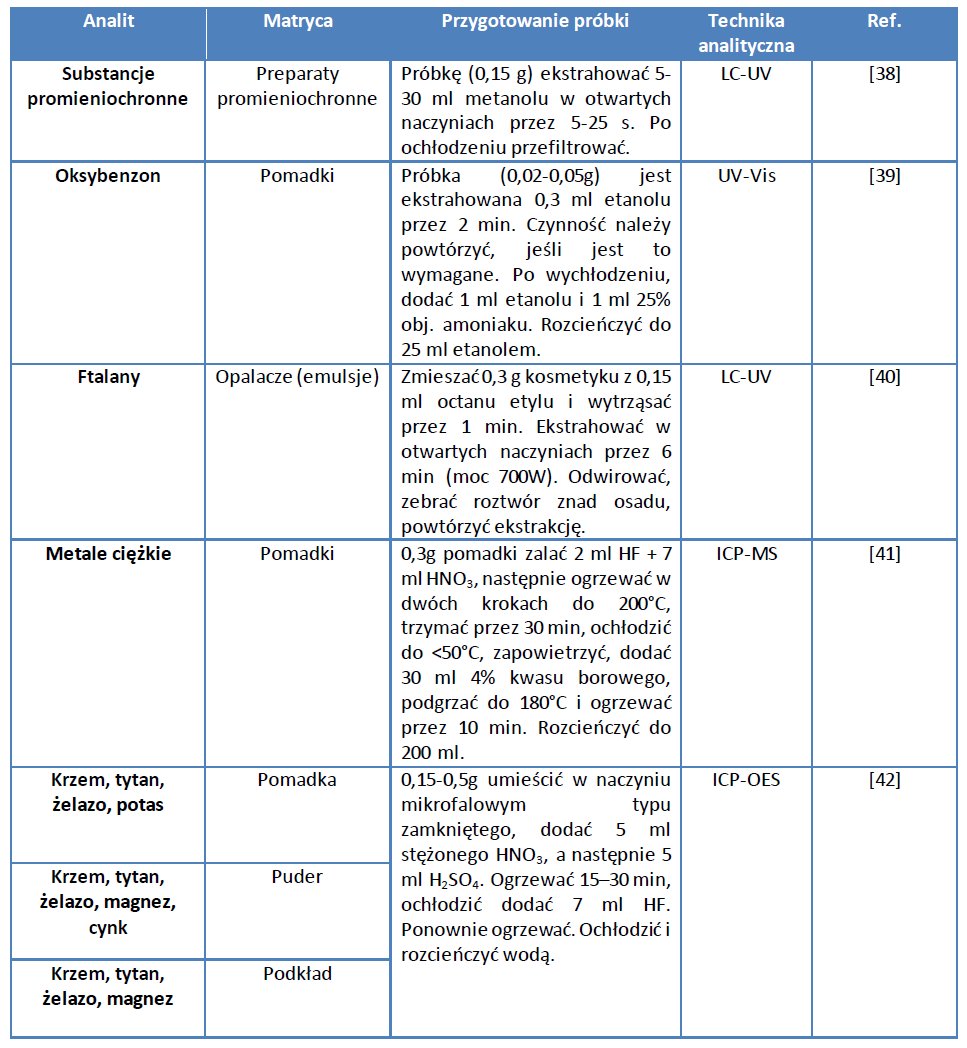
Ekstrakcja wspomagana mikrofalami (MAE) wykorzystuje promieniowanie mikrofalowe również do przygotowania próbek kosmetycznych do analiz. Główna przewaga tej metody nad metodą Soxhleta kryje się w wyższej wydajności otrzymywanej w znacznie krótszym czasie [36]. W zasadzie, w przypadku mikrofalowej ekstrakcji materiałów kosmetycznych o dużej zawartości związków organicznych, wysokie wydajności są otrzymywane nawet w przypadku oddziaływania analitu i matrycy [37]. W tabeli 1 zebrano dane nt. przygotowania kosmetyków do analizy.
W zależności od rodzaju kosmetyku stosuje się różne warunki przygotowania próbki. Jedynie w przypadku analizy metali i oksybenzonu wykorzystuje się zamknięte probówki do systemu mikrofalowego. Zamknięty system mikrofalowy stosuje się także w przypadku analizy próbek zawierających dużą zawartość tłuszczy i olejów, np. pomadek. Najczęściej używanymi rozpuszczalnikami w ekstrakcji są metanol, etanol lub octan etylu, zaś w przypadku roztwarzania – stężone kwasy.
Zastosowanie w medycynie, fizjoterapii i kosmetyce
Promieniowanie mikrofalowe może być także wykorzystywane w medycynie i w zabiegach kosmetycznych. Istotą ich leczniczego działania jest przegrzewanie tkanek, noszące nazwę diatermii [43, 44]. Ciepłolecznictwo, należące do jednych z najstarszych metod leczenia, polega na przekazywaniu energii cieplnej drogą przewodzenia, przenoszenia i promieniowania lub na wytworzeniu ciepła w tkankach, wskutek przepływu prądu o dużej częstotliwości, oddziaływania pól
elektrycznych, magnetycznych lub elektromagnetycznych [44]. Wyróżnia się dwa rodzaje ciepła [43]:
1. ciepło dostarczone do organizmu z zewnątrz (np. sauna);
2. ciepło wytwarzane w tkankach (tzw. ciepło endogenne), wytwarzane za pomocą drgań elektromagnetycznych.
Tabela 1. Dane na temat przygotowania kosmetyków do analizy.
Płyny ustrojowe oraz struktury tkankowe zawierają elektrolity, które w polu elektrycznym migrują w kierunku elektrody o przeciwnym ładunku. W wyniku ruchu jonów dochodzi do ich zderzeń, skutkuje to powstaniem ciepła i podniesieniem temperatury tkanek [43].
W zależności od długości fali wyróżnia się diatermię krótkofalową, mikrofalową i prądy d’Arsonvala. Diatermia mikrofalowa polega na rozgrzaniu tkanek w polu elektromagnetycznym o częstotliwości mikrofalowej, fale te docierają płycej niż w diatermii krótkofalowej [43]. W pierwszej fazie zabiegu tkanki są oziębiane, a następnie przy stopniowym zwiększaniu mocy, rozgrzewane do temperatury przekraczającej 40°C [44]. Część mikrofal odbija się od powierzchni tkanki a część zostaje przez nią pochłonięta. W największym stopniu przegrzewają się mocno uwodnione tkanki, natomiast tkanka tłuszczowa rozgrzewa się bardzo słabo [44]. Zastosowanie promieniowania mikrofalowego o wysokiej częstotliwości, oprócz efektów cieplnych, sprzyja również polepszeniu ukrwienia tkanek, przyspieszeniu przemian metabolicznych oraz obniżeniu pobudliwości nerwowo- mięśniowej. Udowodniono również działanie przeciwbólowe, przyspieszenie procesów wchłaniania tkankowego a także poprawienie struktury kolagenu (przegrzane włókna kolagenowe kurczą się i napinają, czego konsekwencją jest poprawa jakości skóry), stymulację fibroblastów do odbudowy oraz wytwarzania kolagenu i elastyny, dając efekt liftingu. Zwiększa się przy tym gęstość, elastyczność i napięcie skóry [43]. Diatermia mikrofalowa stosowana jest w leczeniu przewlekłego zapalenia stawów i w zapaleniach okołostawowych, przy zapaleniu układu rozrodczego, w nerwobólach oraz w bólach związanych ze zwyrodnieniem kręgosłupa. Przeciwwskazaniem do stosowania diatermii mikrofalowej są choroby nowotworowe, zaburzenia krążenia, stany zapalne żył, obrzęki, nadwrażliwość na światło, żylaki, obecność metalowych łączeń, rozrusznika serca oraz ciąża [44].
Promieniowanie mikrofalowe wykorzystywane jest także w rewolucyjnej metodzie leczenia osób cierpiących na hiperhydrozę, czyli nadmierną potliwość. Amerykańska Agencja ds. Żywności i Leków FDA zatwierdziła ten zabieg w 2011 roku do leczenia nadpotliwości w okolicach pach. System zamyka gruczoły potowe poprzez kierowanie na nie promieniowania mikrofalowego [45].
Kolejnym zastosowaniem terapeutycznym mikrofal we współczesnej medycynie jest Przezcewkowa Termoterapia Mikrofalowa (Transurethral microwave thermotherapy – TUMT), która jest skuteczną i bezpieczną metodą leczenia przerostu prostaty. Leczenie polega na wprowadzeniu w cewkę moczową specjalnego cewnika, wyposażonego w antenkę mikrofalową, która emituje mikrofale podgrzewające i niszczące przerośniętą tkankę gruczołu krokowego [46].
Promieniowanie mikrofalowe oprócz zastosowania w zabiegach medycznych i kosmetycznych może być również wykorzystane przy wytwarzaniu formulacji kosmetycznych. Podczas procesu technologicznego można je stosować do mikrobiologicznego odkażania surowców i produktów oraz ekstrakcji wspomaganej mikrofalami [47].
Gotowy wyrób kosmetyczny może być analizowany pod kątem śladowych ilości metali ciężkich. Niektóre typowe dla kosmetyków składniki, jak np. talk, tlenek cynku, węglan magnezu, tlenek tytanu(IV) i różne pigmenty są praktycznie nierozpuszczalne w wodzie. Analiza wymagałaby zatem roztworzenia próbki stężonymi kwasami, można jednak zastosować mineralizację mikrofalową, która stanowi znaczne ułatwienie [42].
PODSUMOWANIE
Zastosowanie promieniowania mikrofalowego umożliwia zminimalizowanie kosztów oraz czasu przeprowadzania syntez/ reakcji, gdyż pod jego wpływem dochodzi do znacznego zwiększenia szybkości reakcji w porównaniu do syntez/ reakcji przeprowadzanych w sposób konwencjonalny. Aktywacja mikrofalami przyczynia się także do zmniejszenia ilości lub całkowitego wyeliminowania rozpuszczalników, które są niezbędne do prowadzenia syntez/reakcji w sposób tradycyjny.
LITERATURA:
1. Czepirski L., Łaciak B., Komorowska-Czepirska E., Wykorzystanie promieniowania mikrofalowego w technologii adsorbentów węglowych, Wydawnictwo PCz, 2006, 59, 87–93.
2. Burczyk B., Zielona chemia, Oficyna Wydawnicza Politechniki Wrocławskiej, Wrocław, 2006.
3. Sawicka M., Soroka J., Soroka K., Gąsiorowska M., Wiadomości Chemiczne, Polskie Towarzystwo Chemiczne, 2007, 61, 891-911.
4. Nowak I., Kowalska S., Analityka: nauka i praktyka, 2007, 4, 4-10.
5. Neas E.D., Collins M.J., American Chemical Society, 1988, 7-32.
6. Kappe C.O., Angew. Chem.Int. Ed., 2004, 43, 6250.
7. Strauss C.R., Handbook of Green Chemistry and Technology, Oxford, 2002, 397-415.
8. Brud W.S., Konopacka-Brud I., Podstawy perfumerii, Łódź, 2009.
9. Craveiro A.A., Matos F.J.A., Alencar J.W., Plumel M.M., Flavour Frag. J., 1989, 4, 43-44.
10. Nan Lee B., Patent application publication US 2010/0288621 A1, 2010.
11. Stashenko E.E., Jaramillo B.E., Martinez J.R., J. Chromatogr. A, 2004, 1025, 105-113.
12. Golmakani M.T., Rezaei K., Food Chem., 2008, 109, 925-930.
13. Golmakani M.T., Rezaei K., J. Lipid Sci. Technol., 2008, 110, 448-454.
14. Rezvanpanah S., Rezaei K., Hadi Razavi S., Moini S., Food Sci. Technol. Res. 2008, 14, 311-314.
15. Thi T., Anh T.H., Thach L.N., J. Essent. Oil Bear. Plants, 2008, 11, 154-161.
16. Flamini G., Tebano M., Cioni P.L., Ceccarini L., Ricci A.S., Longo I., J. Chromatogr. A, 2007, 1143, 36-40.
17. Sahraoui N., Abert Vian M., Bornard I., Boutekedjiret C., Chemat F., J. Chromatogr. A, 2008, 1210, 229-233.
18. Chemat F., Smadja J., Lucchesie M.E., European Patent EP 1 439218 B 1, 2004.
19. Chemat F., Lucchesie M.E., Smadja J., American Patent US 0187340 A 1, 2004.
20. Lucchesie M.E., Smadja J., Bradshaw S., Louw W., Chemat F., J. Food Eng. 2007, 79,1079-1086.
21. Ferhat M.A., Meklati B.Y., Visinoni F., Abert Vian M., Chemat F., Chem. Today, 2008, 26, 48-50.
22. Bayramoglu B., Sahin S., Sumnu G., J. Food Eng. 2008, 88, 535-540.
23. Uysal B., Sozmen F., Buyuktas B.S., Nat. Prod. Commun., 2010, 5, 111-114.
24. Wang Z., Ding L., Li T., Zhou X., Wang L., Zhang H., Liu L., Li Y., Liu Z., Wang H., Zeng H., He H., J. Chromatogr. A, 2006, 1102, 11-17.
25. Wang Z., Wang L., Li T., Zhou X., Ding L., Yu Y., Yu A., Zhang H., Anal. Bioanal. Chem., 2006, 386, 1863-1868.
26. Zhai Y., Sun S., Wang Z., Cheng J., Sun Y., Wang L., Zhang Y., Zhang H., Yu A., J. Sep. Sci., 2009, 32, 3544-3549.
27. Chemat, F., Cravotto G. (ed.), Microwave-assisted Extraction for Bioactive Compounds, Springer, 2013.
28. López-Ávila V.J., J. Assoc .Off. Anal. Chem., 1999, 82, 217.
29. Vetter W., Weichbrodt M., Hummert K., Glotz D., Luckas B., Chemosphere, 1998, 37, 2425.
30. Virot M., Tomao V., Ginies C., Visinoni F., Chemat F. J. Chromatogr. A, 2008, 1196, 147.
31. Mahesar S.A., Sherazi S.T.H., Kamran A., Aftab K., Bhanger M.I., van de Voort F.R., Sedmanb J., Talanta, 2008, 75, 1240.
32. Bermejo-Barrera P., Moreda-Piñeiro A., Bermejo-Barrera A., Talanta, 2001, 57, 969.
33. Ruiz-Jiménez J., Luque García J.L., Luque de Castro M.D., Anal. Chim. Acta., 2003, 480, 231.
34. Cravotto G., Boffa L., Mantegna S., Perego P., Avogadro M., Cintas P., Ultrason Sonochem., 2008, 15, 898.
35. Bjoërklund E., von Holst C., Anklam E., TrAC, 2002, 21(1), 40-52.
36. Cabaleiro N., De la Calle I., Bendicho C., Lavilla I., Anal. Methods, 2013, 5, 323-340.
37. Sanchez-Prado L., Garcıa-Jares C., Llompart M., J. Chromatogr. A, 2010, 1217, 2390-2414.
38. Shih Y., Cheng F.C., J. Chromatogr. A, 2000, 876, 243-246.
39. Salvador A., Chisvert A., Camarasa A., Pascual-Marti M.C., March J.G., Analyst, 2001, 126, 1462-1465.
40. Feng C.H., Jiang S.R., Microchim. Acta, 2012, 177, 167-175.
41. Hepp N.M., Mindak W.R., Cheng J., J. Cosmet. Sci., 2009, 60, 405-414.
42. Besecker K.D., Rhoades Ch.B., Jr., Jones B.T., Atomic Spectroscopy, 1998, 19, 48-54.
43. Noszczyk M. (ed.), Kosmetologia pielęgnacyjna i lekarska, Wydawnictwo Lekarskie PZWL, Warszawa, 2010.
44. Mika T., Fizykoterapia, Wydawnictwo Lekarskie PZWL, Warszawa, 1996.
45. http://www.hopkinsmedicine.org/sweat_disorders/hyperhidrosis/treatments/microwave_treatment.html.
46. Dineen M.K., Shore N.D., Lumerman J.H., Corica A.P., Urology, 2008, 71, 873-877.
47. Jasnow S.B., Smith J.L., Appl. Microbiol., 1975, 30 (2), 205-211.





