Nota aplikacyjna CEM Corp.
strony wersji drukowanej: 38-39
strony wersji drukowanej: 38-39
Wiedza na temat egzogennych aminokwasów oraz oddziaływań wiążących jest kluczowa dla zrozumienia aktywności peptydów. Jednym ze sposobów na zrozumienie tych złożonych interakcji jest otrzymanie biblioteki związków opartych o skan alaninowy. Skanowanie alaniną jest wykorzystywane do identyfikacji miejsc interakcji białko-białko poprzez systematyczną podstawienie grup funkcyjnych wzdłuż łańcucha peptydowego grupą metylową przy jednocześnie zachowanej konformacji łańcucha.1
Pomimo niebywałej przydatności metody, otrzymywanie tego typu bibliotek jest czasochłonne. Na ogół synteza peptydów jest procesem długotrwałym, a to ze względu na mnogość etapów i występujące ryzyko zajścia niepożądanych reakcji ubocznych; utworzenie puli związków bezpośrednio zwielokrotnia ilość poszczególnych etapów co zależne jest od wielkości biblioteki. Zastosowanie energii promieniowania mikrofalowego do deprotekcji aminokwasów oraz ich kondensacji w sposób istotny wpływa na obniżenie prawdopodobieństwa zajścia reakcji ubocznych, wzrost wydajności reakcji, oraz rozbijanie agregatów (kolejny powszechnie występujący problem, szczególnie w przypadku odpowiednio długich peptydów).2
Mikrofalowe syntezatory peptydów nowej generacji wykorzystujące metodę HE-SPPS mają ułatwić proces otrzymywania bibliotek związków. Główne udoskonalenia sprzętu i metodyki spowodowały skrócenie czasu cyklu syntezy do zaledwie 4 minut i znacząco zredukowały zużycie rozpuszczalników. Dzięki tym szybkim metodom, synteza puli związków może być wykonana jedna po drugiej w czasie, w którym może śmiało konkurować z syntezatorami pracującymi równolegle, jednocześnie przy wyższej czystości otrzymanych peptydów. W wyniku tego otrzymywanie bibliotek związków stało się łatwiejsze do osiągnięcia.
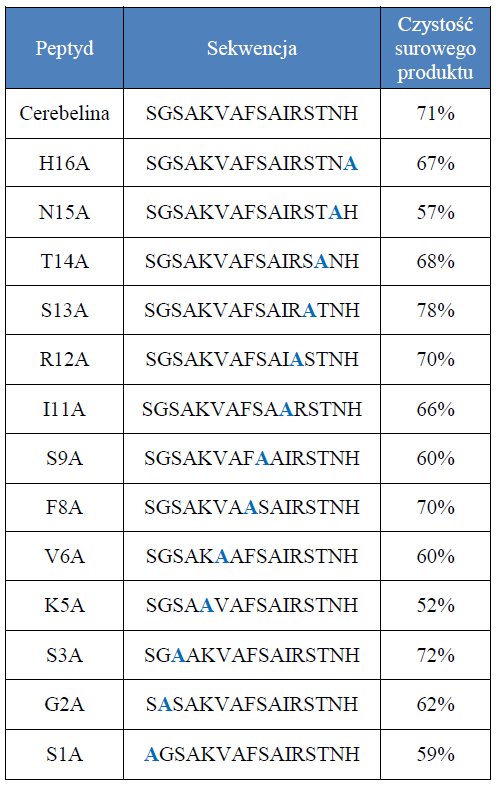
Cerebelina składa się z 16 reszt aminokwasowych. Występuje w komórkach Purkinjego w mózgu i może być użyta jako środek pomocniczy do oceny rozwoju neuronów. Wykazano, że odgrywa ona rolę w utrzymywaniu równoległych włókien synaps komórek Purkinjego.4 Dowiedziono również, że Cerebelina powoduje zwiększenie uwalniania katecholaminy z ludzkiego gruczołu nadnerczowego.5 Synteza czternastu peptydów - biblioteki związków otrzymanej na drodze skanowania Cerebeliny za pomocą alaniny, została przeprowadzona przy użyciu metody syntezy na nośniku stałym z jednoczesnym wykorzystaniem automatycznego, mikrofalowego syntezatora peptydów Liberty Blue.

Aparatura
Syntezator peptydów Liberty Blue jest jedynym urządzeniem na rynku, który może zakończyć pełny cykl (wliczając płukanie) w przeciągu 4 minut. W wyniku tych własności jest to układ, który może przeprowadzić syntezę 20-aminokwasowego peptydu w zaledwie 90 minut, co jest szybkością imponującą, szczególnie podczas syntezy 14-składnikowej grupy związków złożonych z 16 aminokwasów każdy. Żywicę wprowadza się do naczynia reakcyjnego Liberty Blue, zaś uprzednio odważone, niezbędne aminokwasy umieszcza się w falkonach w odpowiednio oznaczonych pozycjach, co ułatwia przygotowanie urządzenia do pracy. Pożądana sekwencja jest wprowadzana za pośrednictwem odpowiedniego oprogramowania, które zapewnia zoptymalizowane warunki procesu acylowania każdego z aminokwasów, a tym samym zwiększa całkowitą efektywność syntezy. W celu stworzenia biblioteki związków, wiele żywic może być umieszczonych w układzie, dzięki opcjonalnemu akcesorium - podajnikowi żywicy HT12. Podczas syntezy żywica jest automatycznie przenoszona do naczynia reakcyjnego, zachodzi synteza peptydu, zaś jej efekt w postaci koniugatu żywicy z peptydem zostaje na powrót przeniesiony do podajnika żywicy. Kolejna jej porcja jest automatycznie przenoszona do naczynia reakcyjnego, gdzie zachodzi synteza następnego peptydu. Podczas procesu syntezy, wszelkie wymagane roztwory są dodawane do mieszaniny reakcyjnej bez ingerencji użytkownika przy wykorzystaniu technologii Flex-Add, zapewniającej właściwe ich ilości i szybkość ich dodawania za każdym razem. Po zakończonej syntezie peptyd może być odszczepiony od żywicy w sposób tradycyjny w temperaturze pokojowej, bądź w sposób szybszy przy użyciu rozwiązania oferowanego przez moduł o nazwie Accent Microwave Cleavage System.
Synteza peptydów
Peptydy zostały zsyntezowane za pomocą syntezatora Liberty Blue na 0,27 g nośnika Fmoc-Rink Amide MBHA (osadzenie 0,36 mmol/g). Deprotekcja (20% roztwór piperydyny w DMF zawierający 0,1 M HOBt) była prowadzona przez 1 min w 90 °C. Etapy acylowania realizowane były przy 5-krotnym nadmiarze Fmoc-AA-OH w stosunku 1:1:1, AA/DIC/HOBt przez 2 min w 90°C (5 min w 50°C dla His; 2x2 min w 90 °C dla Arg). Syntezy te nie były poddane optymalizacji. Odszczepianie peptydu realizowano w mieszaninie 92,5:2,5:2,5:2,5 TFA/H2O/TIS/DODT przez 30 min w 38°C przy użyciu Accent Peptide Cleavage System. Po tym etapie, surowy peptyd był wytrącany i przemywany za pomocą eteru dietylowego.
Wyniki i dyskusja
14 związków otrzymanych na drodze syntezy mikrofalowej z uwzględnieniem skanu analinowego Cerebeliny zostało zsyntezowanych w skali 0,1 mmol. Czystość wszystkich surowych peptydów przekraczała 50% (tabela 1). Dzięki wykorzystaniu Liberty Blue do syntezy oraz Accent do odszczepiania, każdy z peptydów był uzyskiwany w czasie krótszym niż 70 minut, zaś cała pula związków została otrzymana w niespełna dobę.
Tabela 1: Grupa otrzymanych analogów Cerebeliny.
Wnioski
Szybkość i efektywność mikrofalowych syntezatorów peptydowych nowej generacji zmieniły sposób otrzymywania bibliotek związków peptydowych. Redukcja czasu trwania cyklu do 4 minut umożliwiła szybkie, sekwencyjne generowanie biblioteki związków, wraz z całkowitą kontrolą nad każdym z peptydów, co niemożliwe byłoby do osiągnięcia w tym samym czasie metodami tradycyjnymi. Dodatkowo każdy z otrzymywanych kolejno peptydów jest gotowy do odszczepiania oraz oczyszczania, co eliminuje efekt „wąskiego gardła” występujący po etapie syntezy przy użyciu metod tradycyjnych. Połączenie Liberty Blue oraz Accent, ponownie zrewolucjonizowało syntezę peptydów.
Literatura:
1 Morrison K L, Weiss G A. Combinatorial alanine-scanning. Current Opinion in Chemical Biology. 2001; 5: (3). 302-307.
2 References include: Collins, J.M., Leadbeater, N.E. Microwave energy: a versatile tool for biosciences. Organic & Biomolecular Chemistry. 2007; 5: (8). 1141-1150. Palasek, S.A., Cox, Z.J., Collins, J.M. Limiting racemation and aspartimide formation in microwave-enhanced Fmoc solid phase peptide synthesis. Journal of Peptide Science. 2007. 13: (3). 143-148.
3Collins, J.M.,Porter, K.A., Singh, S.K., Vanier, G.S. High-Efficiency Solid Phase Peptide Synthesis (HE-SPPS). 2014; 16: (3), 940-943.
4 Selimi F, Heintz N. How neurons keep in touch. Nature Neuroscience. 2005; 8: (11). 1417-1418.
5 Mazzocchi G, Andreis PG, De Caro R, Aragona F, Gottardo L, Nussdorfer GG. Cerebellin enhances in vitro secretory activity of human adrenal gland. J. Clinical Endocrinology Metabolism. 1999; 84: (2). 632-635.
Literatura:
1 Morrison K L, Weiss G A. Combinatorial alanine-scanning. Current Opinion in Chemical Biology. 2001; 5: (3). 302-307.
2 References include: Collins, J.M., Leadbeater, N.E. Microwave energy: a versatile tool for biosciences. Organic & Biomolecular Chemistry. 2007; 5: (8). 1141-1150. Palasek, S.A., Cox, Z.J., Collins, J.M. Limiting racemation and aspartimide formation in microwave-enhanced Fmoc solid phase peptide synthesis. Journal of Peptide Science. 2007. 13: (3). 143-148.
3Collins, J.M.,Porter, K.A., Singh, S.K., Vanier, G.S. High-Efficiency Solid Phase Peptide Synthesis (HE-SPPS). 2014; 16: (3), 940-943.
4 Selimi F, Heintz N. How neurons keep in touch. Nature Neuroscience. 2005; 8: (11). 1417-1418.
5 Mazzocchi G, Andreis PG, De Caro R, Aragona F, Gottardo L, Nussdorfer GG. Cerebellin enhances in vitro secretory activity of human adrenal gland. J. Clinical Endocrinology Metabolism. 1999; 84: (2). 632-635.
Tłumaczenie: redakcja Laborant.pl





