Damian Neubauer, Maciej Jaśkiewicz
Gdański Uniwersytet Medyczny
strony wersji drukowanej: 50-58
strony wersji drukowanej: 50-58
Mikroorganizmy od zawsze towarzyszyły człowiekowi, stanowiąc nieodłączny element istnienia jak i przemijania. Współistnienie zawsze oznacza próbę sił, swoistą konkurencję o otaczające dobra, np. energię, miejsce, substancje odżywcze, wodę. Pojawiające się wraz z rozwojem cywilizacji potrzeby oraz zdobyta wiedza, doprowadziły nie tylko do opracowania metod walki z patogenami, lecz także do wykorzystania ich potencjału wytwórczego. Jednym z przejawów tego typu aktywności jest biosynteza polimerów mikrobiologicznych, których podstawą otrzymywania są właśnie drobnoustroje. Materiały takie znajdują szerokie zastosowanie w medycynie, farmacji i przemyśle opakowaniowym.
Inżynieria genetyczna pozwala zmienić informację o biosyntezowanym produkcie, co poszerza wachlarz możliwych do otrzymania polimerów – umożliwia manipulację ich właściwościami. Polimery te można rozróżnić ze względu na jednostki strukturalne, które mogą być sacharydami, estrami, bądź amidami. W niniejszym artykule przedstawionych zostało kilka często spotykanych polimerów bakteryjnych znajdujących zastosowanie w życiu codziennym.
Alginian
Jest kopolimerem posiadającym wiązania β-1,4-glikozydowe pomiędzy resztami kwasu β-D-mannuronowego (M) i α-L-guluronowego (G), przy czym struktura polimeru jest zróżnicowana i zawiera elementy repetytywne - bloki MM, GG, jak i MG. Alginian pozyskiwany jest ze ściany komórkowej brunatnic (Phaeophyceae) oraz z hodowli bakteryjnych Azotobacter vinelandi, czy Pseudomonas aeruginosa. Sztywność łańcucha alginianu rośnie dla poszczególnych bloków strukturalnych w następującej kolejności: MG, MM, GG.
Ich udział w strukturze ma więc odzwierciedlenie we właściwościach polimeru, takich jak elastyczność i synereza (kurczenie się żelu wraz z wydzielaniem się z niego wody). W przypadku alginianu bakteryjnego, będącego egzopolisacharydem - EPS, obserwuje się występowanie modyfikacji chemicznych polegających na O-2 i/lub O-3 acetylowaniu reszt kwasu mannuronowego, a także epimeryzacji (epimeraza C-5 mannuronowa). Przypuszcza się, że acetylacja ma istotny wpływ na proces powstawania biofilmu we wczesnych fazach, gdy komórki ulegają agregacji tworząc mikrokolonie. Ponadto, polisacharyd P. aeruginosa nie posiada w strukturze alginianu bloków G, a jedynie dwa pozostałe typy. Alginian daje możliwość immobilizacji komórek i enzymów na swej powierzchni, co znajduje zastosowanie w procesach biotechnologicznych (synteza w bioreaktorach). Przemysłowo produkowane typy alginianu to kwas alginianowy, alginian sodu, potasu, amonu, magnezu, wapnia, trietanoloaminy oraz alginian glikolu propylenowego. Alginiany w obecności kationów dwuwartościowych przechodzą w formę żelu, co spowodowane jest chelatowaniem jonów i tworzeniem się agregatów tzw. „egg-box”. Stosowane są one w leczeniu refluksu żołądkowego, do kapsułkowania, jako składnik tabletek (modulacja kinetyki uwalniania substancji czynnej), emulgatory, plastyfikatory, lepiszcze, naturalne dezintegranty, w opatrunkach, jako środki do mocowania protez dentystycznych oraz środki zwiększające lepkość. Główny udział w produkcji przemysłowej przypada na alginian pochodzący z alg, ze względu na mniejszą opłacalność otrzymywania alginianu bakteryjnego. Niedogodność ta może w przyszłości zostać zniwelowana np. poprzez zastosowanie narzędzi inżynierii genetycznej, co pozwoli na pełne wykorzystanie potencjału wytwórczego bakterii, w tym modyfikacji biosyntezowanych polimerów.
Celuloza bakteryjna
Celuloza bakteryjna jest polisacharydem, w którym cząsteczki glukozy połączone są liniowo wiązaniami β-1,4-glikozydowymi. Produkowana jest przez bakterie fermentacji octowej z gatunku Acetobacter xylinum, ale również może być syntetyzowana przez bakterie z rodzaju Agrobacterium, Pseudomonas czy Rhizobium. W warunkach hodowlanych otrzymywana jest czysta celuloza. W odróżnieniu od celulozy pochodzenia roślinnego jej włókna są znacznie dłuższe i mocniejsze, a ich strukturę nadcząsteczkową można w znacznym stopniu modyfikować na etapie syntezy. Dodatkowo charakteryzuje się niską toksycznością, jest biozgodna oraz biodegradowalna. Dzięki takim właściwościom znalazła szereg zastosowań m.in. w medycynie (biomateriały opatrunkowe), przemyśle spożywczym jak również kosmetycznym. Ponadto, opracowano wiele metod pozwalających na zastosowanie z powodzeniem celulozy bakteryjnej w przemyśle papierniczym.
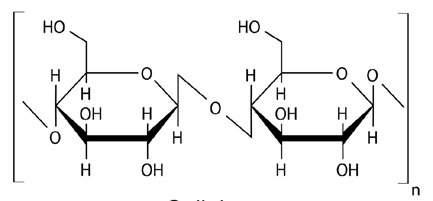
Ryc. 1. Struktura celulozy.
Dekstran
Dekstran jest polimerem D-glukozy o wysokim ciężarze cząsteczkowym, powstałym w wyniku fermentacji sacharozy przez bakterie z rodzaju Leuconostoc, Streptococcus i Lactobacillus. W jego szkielecie dominują wiązania α-1,6-glikozydowe (90-95%), rzadziej α-1,4- i α-1,3-glikozydowe. Struktura dekstranu związana jest przede wszystkim z rodzajem szczepu bakteryjnego, który został wykorzystany przy jego produkcji. Komercyjnie, wykorzystywane są bakterie z gatunków Leuconostoc mesenteroides i L. dextranicum. Dekstran, jako produkt ostateczny obróbki enzymatycznej sacharozy ma postać żelu. Wykorzystywany jest między innymi w sączeniu molekularnym przy oczyszczaniu i separacji makromolekuł takich jak białka, kwasy nukleinowe czy polisacharydy. Ponadto dekstrany wykorzystywane są w transfuzjologii jako preparaty krwiozastępcze (dokładnie jako środek zastępczy osocza). Dzięki zdolności wiązania wody roztwory dekstranu wywierają znaczne ciśnienie osmotyczne, co wpływa na zwiększenie objętości osocza. W następstwie tego dochodzi do polepszenia przepływu krwi w naczyniach włosowatych oraz zmniejszenia jej lepkości. Roztwory dekstranu wykazują cechy cieczy newtonowskich, a ich lepkość zależy od stężenia roztworu oraz stosunku między wiązaniami α-1,6-; α-1,4- i α-1,3-glikozydowymi. Okres półtrwania makromolekuły w organizmie wynosi od 6 do 8 godzin, a wydalana jest głównie przez nerki (w niewielkim stopniu poprzez płuca). Frakcja niewydalona, metabolizowana jest w wątrobie, gdzie produktami końcowymi są dwutlenek węgla oraz woda. Dekstran jest również wykorzystywany jako składnik roztworów stosowanych do krioprezerwacji oraz przechowywania organów w transplantologii. Stosowany jest również jako lubrykant w płynach do oczu, czy we wlewach dożylnych jako środek ułatwiający rozpuszczanie (np. żelaza).
Gellan
Gellan, inaczej guma gellan, jest liniowym, anionowym polisacharydem produkowanym przez niepatogenny szczep Sphingomonas elodea ATCC 31461. Polimer ten utworzony jest z powtarzających się jednostek tetrasacharydu, w skład którego wchodzą dwie cząsteczki D-glukozy, jedna cząsteczka kwasu D-glukuronowego oraz jedna cząsteczka L-ramnozy. Cząsteczki tego polimeru wykazują znaczną stabilność. Zarówno w zmiennych warunkach termicznych jak i w środowisku kwaśnym. O potencjalnym zastosowaniu gumy gellan decydują takie cechy jak wysoka przejrzystość oraz dobre uwalnianie aromatów. Z tego powodu substancja ta jest stosowana głównie w przemyśle spożywczym, jako substancja stabilizująca, zagęszczająca oraz żelująca (E418). Ze względu na swoją termostabilność gellan może służyć jako alternatywna dla agaru mikrobiologicznego, w szczególności w hodowli bakterii termofilnych. Znalazł on również swoją aplikację w przemyśle farmaceutycznym jako substancja pomocnicza, często będąca nośnikiem w ostatecznej postaci leku.'
Kefiran
Kefiran jest przezroczystym lub jasnożółtym otoczkowym polisacharydem wydzielanym przez bakterie z rodzaju Lactobacillus, będących elementem ziaren kefiru1.
***
1ziarno kefirowe – inaczej grzybek kefirowy - symbiotyczny zespół mikroorganizmów tradycyjnie wykorzystywany jako kultura starterowa przy produkcji kefiru. Są to kuliste, nieregularne struktury zbudowane z białek, polisacharydów, bakterii kwasu mlekowego (m.in. Lactobacillus acidophilus, L. casei, L. bulgaricus, Streptococcus thermophillus), bakterii kwasu octowego – Acetobacter, oraz drożdży fermentujących i niefermentujących laktozę.
***
Jest to dobrze rozpuszczalny w wodzie polimer, złożony z reszt D-glukozy i D-galaktozy (w stosunku molowym 1:1). Dowiedziono również, że wykazuje on właściwości przeciwbakteryjne, przeciwgrzybicze, przeciwnowotworowe, a także immunomodulacyjne oraz protekcyjne wobec tkanki nabłonkowej. Poza zastosowaniem przy produkcji kefiru wykorzystywany jest jako substancja zwiększająca lepkość i lepkosprężystość produktów mlecznych. Ponadto kefiran może być użyty w produkcji nietoksycznych i biodegradowalnych opakowań dla produktów spożywczych.

Rys. 1. Ziarno kefirowe.
Ksantan
Ksantan, inaczej guma ksantanowa, jest egzopolisacharydem zbudowanym głównie z podjednostek D-glukozy, D-mannozy, kwasu D-glukurunowego (stosunek molowy 2:2:1). Zawiera także grupy acetylowe i reszty kwasu pirogronowego. Syntezowany jest na skalę przemysłową na drodze tlenowej fermentacji węglowodanów przez roślinny patogen bakteryjny - Xanthomonas campestris. Polimer ten tworzy pseudoplastyczne roztwory o stosunkowo dużej lepkości (1% roztwór wodny w temperaturze pokojowej posiada lepkość dynamiczną równą ok. 1000 cP), tzw. hydrokoloidy o charakterze polianionu. Ksantan znajduje zastosowanie m.in. w przemyśle spożywczym i farmaceutycznym, gdzie wykorzystywane są jego właściwości do stabilizacji i rozpraszania/wiązania cząstek stałych, niemieszalnych cieczy, oraz gazów w roztworach wodnych (faza ciągła). Pełnione przezeń funkcje można określić jako stabilizowanie, zagęszczanie i żelowanie. W celu zwiększenia stopnia żelowania i lepkości wykorzystuje się efekt synergistyczny występujący pomiędzy ksantanem a gluko- i galaktomannanami takimi jak guma guar czy też mączką chleba świętojańskiego (guma karobowa). Ksantan stosowany jest m.in. do produkcji budyniów, sosów, napojów, nadzień, jogurtów, a także w maściach, żelach do oczu i pastach do zębów, oraz jako substancja pomocnicza w tabletkach, regulująca kinetykę uwalniania substancji czynnej, np. poprzez wykorzystanie zjawiska mukoadhezji – adhezja formy leku do błony śluzowej. Zaletą gumy ksantanowej jest jej biozgodność, możliwość stosowania jej w szerokim zakresie pH (1-13) i temperatur oraz wysokim stężeniu soli bez istotnych zmian lepkości. Jednakże w kontekście farmakokinetyki – uwalniania substancji leczniczej, parametry te pozostają kluczowe. W związku z różnym stopniem protonowania grup karboksylowych polimeru w zmieniającym się pH środowiska w kolejnych odcinkach układu pokarmowego kinetyka uwalniania substancji czynnej będzie niejednorodna. Badania przeprowadzone na ksantanie i peptydzie - dhvar 1 (syntetyczny analog histatyny 5), wobec Candida albicans wskazują, że ksantan może być nośnikiem peptydów przeciwdrobnoustrojowych (bioadhezja), przedłużając czas ich działania poprzez spowalnianie szybkości ich degradacji.
Kurdlan
Kurdlan jest liniowym polimerem glukozy, którego reszty połączone są wiązaniami β-1,3-glikozydowymi. Komercyjnie, polisacharyd ten produkowany jest przez modyfikowane genetycznie bakterie szczepu Alcaligenes faecalis. Cechą unikatową tego polimeru jest zdolność do utrzymywania formy elastycznego żelu, także podczas podgrzewania roztworu powyżej 55 ºC. Co więcej, nie topi się, nawet w temperaturze powyżej 100 ºC (m.in. podczas termicznej sterylizacji), oraz jest odporny na mrożenie i rozmrażanie. Kurdlan dzięki swoim właściwościom znalazł zastosowanie przede wszystkim w przemyśle farmaceutycznym i spożywczym np. jako stabilizator, modyfikator tekstury oraz substancja wiążąca wodę.
Lewan
Lewan jest egzopolisacharydem produkowanym przez wiele gatunków bakterii oraz roślin jednoliściennych. Struktura lewanu opiera się na powtarzalnych jednostkach fruktfuranozy (homopolimer) połączonej wiązaniami β-2,6-glikozydowymi. Dla komórki bakteryjnej fruktan ten stanowi fizyczną barierę, będącą swoistym buforem wobec środowiska, która wzmaga odporność na stres zewnątrzkomórkowy (osmo- i krioprotektant), wspomaga asymilację składników odżywczych, a także jest czynnikiem patogenezy chorób powodowanych mikroorganizmami. Dodatkowo lewan bierze udział w tworzeniu biofilmu bakteryjnego. Wielkość syntezowanych cząstek jest różna dla roślin i bakterii, przy czym dla organizmów eukariotycznych waha się od 2x103 do 3,3x104 [Da], zaś dla prokariotycznych od 2x106 do 108 [Da]. W przypadku komórek bakteryjnych, za powstawanie lewanu odpowiedzialny jest enzym należący do klasy transferaz - lewanosacharoza, który przenosi resztę fruktozy z sacharozy na łańcuch cukrowego polimeru. Enzym ten ulega sekrecji do otaczającego bakterię medium. Mikroorganizmami, które syntezują EPS tego typu są bakterie z rodzaju Bacillus sp., Lactobacillus sp., Pseudomonas sp., Streptococcus sp., Xanthomonas sp., Zymomonas sp..
Prowadzone są badania nad wykorzystaniem lewanu do przenoszenia cząsteczek zieleni indocyjaninowej specyficznie do komórek raka piersi w celu ich obrazowania. Specyficzność dystrybucji samoorganizujących się nanocząstek lewanu i barwnika jest wynikiem oddziaływań pomiędzy resztami fruktozy a transporterami glukozy typu 5 (preferencyjny transport fruktozy) nadprodukowanymi w komórkach raka piersi. Lewan stosowany jestłównie jako prebiotyk, czyli nietrawiony składnik żywności, który selektywnie pobudza wzrost sprzyjających organizmowi człowieka mikroorganizmów, często służący im jako źródło węgla. Poglimer ten może być zastosowany w przemyśle spożywczym jako stabilizator, nośnik smaku i zapachu oraz zagęszczacz, zaś w przypadku farmaceutyków posłużyć może jako nośnik substancji czynnej. Dla aplikacji przemysłowych istotne jest także to, że nie wykazuje on cytotoksyczności i mutagenności.
Polihydroksyalkanolany
Do związków polimerycznych produkowanych wewnątrzkomórkowo zaliczamy grupę polihydroksyalkanolanów (PHA), które mogą stanowić do 90% masy komórki bakteryjnej i jednocześnie służąc jej jako zapasowy materiał energetyczny. Mają one właściwości termoplastyczne zbliżone do poliolefin (np. polietylen), a dodatkowo są biodegradowalne i biozgodne. Na rycinie 2 został przedstawiony wzór ogólny grupy polihydroksyalkanolanów. W tej klasie związków znajdują się także kopolimery, czyli materiały polimerowe złożone z więcej niż 1 rodzaju meru. Na skalę przemysłową produkowany jest P3HB [poli-(R)-3-hydroksymaślan] oraz PHBV [poli(3-(R)-hydrokymaślan-ko-3-(R)-hydroksywalerian)]. Organizmami syntezującymi PHA i ich kopolimery jest wiele gatunków bakteryjnych, w tym Cupriavidus necator, Aeromonas hydrophila, Burkholderia sacchari, Escherichia coli, Halomonas baliviensis, Rhodopseudomonas palustris, a także rośliny transgeniczne, u których PHA stanowi relatywnie niewielką część suchej masy, bo ok. 10%. PHBV wykazuje wyższą od PHB termostabilność, wytrzymałość mechaniczną oraz elastyczność. Przeciętna masa syntezowanego polimeru PHA to ok. 106 [Da], aczkolwiek opracowano genetycznie modyfikowany szczep E. coli, który zdolny jest do biosyntezy polimerów o ciężarze cząsteczkowym dochodzącym do 107 [Da]. Struktura otrzymanego polimeru zależy w znacznej mierze od dostarczanych do hodowli bakteryjnej substratów i tak na przykład, by otrzymać kopolimer PHBV, jako źródło węgla mogą posłużyć glukoza i kwas walerianowy. Ilość powstającego PHA i proporcje składowych kopolimeru są zależne od szczepu producenckiego, substratów i warunków hodowli (beztlenowe, tlenowe, sposób doprowadzania substratu). Izolacja produktu jest związana z degradacją komórki, której dokonuje się na drodze chemicznej bądź enzymatycznej. Do dezintegracji chemicznej wykorzystywany jest chloran (I) sodu, często w połączeniu z chloroformem i surfaktantami zmniejszającymi stopień degradacji polimeru, zaś w przypadku lizy enzymatycznej stosuje się enzymy proteolityczne (papaina, pepsyna, trypsyna i in.). PHA stosowane są do enkapsulacji ziaren i nawozów oraz do produkcji biodegradowalnych pojemników i folii. Ze względu na swą wysoką biozgodność wykorzystywane są jako szwy, implanty ortopedyczne, bariery mechaniczne zapobiegające powstawaniu zrostów pooperacyjnych, wewnętrzne systemy uwalniania leków w postaci stentów, rusztowanie dla szpiku kostnego oraz bandaże wspomagające gojenie się ran. Zbliżone do polipropylenu (PP) właściwości fizyczne PHA często pozwalają na stosowanie go jako jego substytutu. W badaniach nad komórkami macierzystymi w hodowlach komórkowych 3D, zastosowanie znajduje PHBV, który stanowi materiał o odpowiedniej do tego celu strukturze, porowatości i chropowatości.
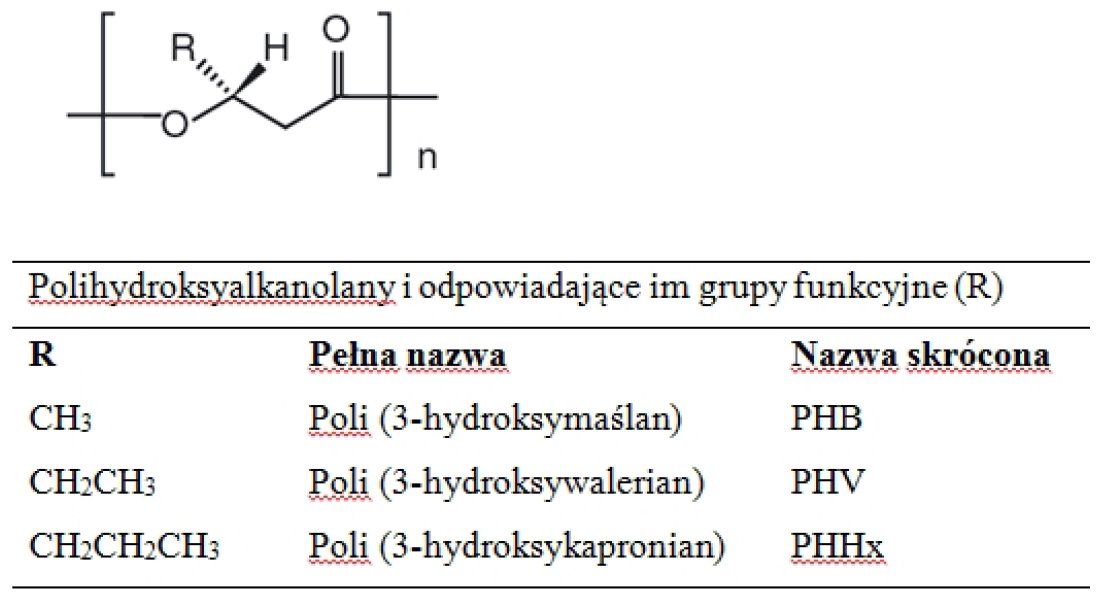
Ryc. 2. Struktura chemiczna polihydroksyalkanolanów.
Welan
Welan jest anionowym polisacharydem tworzonym przez cząsteczki D-glukozy, kwasu D-glukuronowego oraz L-ramnozy, połączonych wiązaniem β-1,4-glikozydowym. Dodatkowo polisacharyd ten rozgałęziony jest w pozycji 3 jednostki D-glukozy, co realizowane jest poprzez wiązanie α-1,3-glikozydowe z cząsteczką L-ramnozy lub L-mannozy. Welan produkowany jest głównie przez szczepy Alcaligenes sp. ATCC 31555. Charakteryzuje się on szeroką stabilnością oraz lepkością w wysokich temperaturach, co sprawia, że znajduje zastosowanie m.in. w przemyśle jako smar przy systemach wiertniczych, stabilizator, substancja cementująca czy zwiększająca lepkość.
Tab. 1. Zestawienie opisanych polimerów bakteryjnych.

Poszukiwanie nowych polimerów
Ze względu na pojawiające się zapotrzebowanie technologiczne na otrzymywanie nowych materiałów, nieustannie poszukuje się polimerów o interesujących i pożądanych właściwościach. Ponadto możliwe jest modyfikowanie już istniejących i poznanych polimerów poprzez acetylowanie, fosforylowanie lub sulfonowanie, co wiąże się z użyciem czynników chemicznych lub biologicznych (enzymy, inżynieria genetyczna). Wśród podejmowanych tropów jest także ten prowadzący do eksploracji nietypowych niszy biologicznych, czyli takich, w których panują ekstremalne, z punktu widzenia człowieka, warunki bytowania, np. w głębinowych osadach morskich. Postępowanie to jest motywowane prostym rozumowaniem – jeżeli w warunkach ekstremalnych bytują drobnoustroje zdolne do wytwarzania EPS, to i wytwarzany EPS posiada odporność na działanie danych warunków zewnętrznych. Prawdziwe będzie także stwierdzenie, że to właśnie EPS przyczynia się do wytrzymałości drobnoustroju na określony, potencjalnie destrukcyjny czynnik. Jednym z takowych polimerów jest ten produkowany przez mikroorganizm morski - Shewanella colwelliana, żyjący w symbiozie z ostrygami. Charakteryzuje się on silnymi właściwościami adhezyjnymi w warunkach wodnych. Badania oczyszczonego egzopolimeru wskazały na obecność Ca, P, S, Si (40-45%), węglowodanów (15-35%, głównie glukozy), lipidów (10%), i białek (< 5%). Termofilny, halo- i alkalofilny szczep T-14 Bacillus licheniformis wyizolowany z gorących kominów hydrotermalnych wód przymorskich w okolicy wyspy Panarea (Włochy), wytwarza EPS o właściwościach przeciwwirusowych (HSV-2) i immunomodulacyjnych. Dowiedziono, że niektóre EPS bogate w ugrupowania siarczanowe, posiadają aktywność przeciwwirusową - zapobiegają penetracji wirusa i hamują działanie ich odwrotnych transkryptaz. W przypadku EPS ekstremofilnych mikroorganizmów wodnych częstym składnikiem są kwasy uronowe, które przyczyniają się do wiązania kationów metali. Kwasy te stanowią 20-50% całkowitej zawartości polisacharydów i w pH panującym w wodzie morskiej występują w formie zjonizowanej. Niektóre psychrotrofowe szczepy Pseudoalteromonas sp. wytwarzają EPS o działaniu flokulacyjnym, biosorpcyjnym, wiążącym metale śladowe, co może zostać zastosowane do bioremediacji metali ciężkich. Istnieje perspektywa zastosowania EPS (tzw. EPS-R, glukoza:galaktoza; 0,68:1,0), syntezowanego przez halofilną bakterię Hahella chejuensis do bioremediacji obszarów skażonych produktami petrochemicznymi. Polimery mogą także naśladować działanie ssaczych glikozaminoglikanów (GAG; merem jest dwucukierzłożony z aminocukru i kwasu uronowego), których aktywność biologiczna dotyczy m.in.odpowiedzi zapalnej i regeneracji tkanek. Przykładem takiego biomateriału jest EPS wydzielany przez szczep HE800 Vibrio diabolicus, który w badaniach in vivo na szczurach wykazał, iż stanowi idealne rusztowanie do adhezji osteoblastów, komórek osteprogenitorowych i perycytów. Wspomaganie funkcji naprawczych kości jest także związane z powinowactwem tego polimeru do jonów wapnia. Jednocześnie nie powoduje on powstawania stanu zapalnego i jest biokompatybilny z tkankami organizmu. Właściwości te pozwalają na konstrukcję protez pokrytych takim polisacharydem.
Podsumowanie
Otrzymywane polimery bakteryjne charakteryzują się wysokim stopniem czystości chemicznej i wykazują mnogość pożytecznych właściwości użytkowych, których nie posiadają ich naturalne analogi pochodzenia roślinnego czy zwierzęcego. Coraz doskonalsze metody ich pozyskiwania pozwalają z dużą wydajnością otrzymać zadowalające ilości związków o pożądanych, czasem i zaskakujących cechach. Bakterie mogą stać się naszymi sprzymierzeńcami w rozwoju przemysłu, medycyny i farmacji. Biorąc pod uwagę dane szacunkowe podające, że dotychczas zidentyfikowano maksymalnie około 10% występujących na Ziemi bakterii, można przypuszczać, że wiele polimerów czeka wciąż na swoje odkrycie.
Piśmiennictwo:1. Florjańczyk Z., Dębowski M., Chwojnowska E., Łokaj K., Ostrowska J. Polimery syntetyczne i naturalne w nowoczesnych materiałach polimerowych.POLIMERY 2009, 54, nr 10.
2. Vu B., Chen M., Crawford R.J., Ivanowa E.P.:Bacterial Extracellular Polysaccharides Involved in Biofilm Formation. Molecules 2009, 14, 2535-2554.
3. Nwodo U.U., Green E., Okoh A.I: Bacterial Exopolysaccharides: Functionality and Prospects. Int. J. Mol. Sci. 2012, 13, 14002-14015.
4. Öner E.T.:Microbial Production of Extracellular Polysaccharides from Biomass. Z. Fang (ed.), Pretreatment Techniques for Biofuels and Biorefineries, 35 Green Energy and Technology,chapter 2. Springer-Verlag Berlin Heidelberg 2013.
5. Prakash U., Singh L., Sharma V.: Role of Xanthan gum (Xanthomonas compestris) in gastroretentive drug delivery system: an overview. Int. Res. J. Pharm. 2013, 4 (4).
6. Ruissen A.L., van der Reijden W.A., van't Hof W., Veerman E.C., Nieuw Amerongen A.V.: Evaluation of the use of xanthan as vehicle for cationic antifungal peptides. J. Control Release. 1999, 28;60(1):49-56.
7. Verliden R.A.J., Hill D.J., Kenward M.A., Williams C.D., Radecka I.: Bacterial synthesis of biodegradable polyhydroxyalkanoates. J. Appl. Microbiol. 2007, 102: 1437-1449.
8. Enshasy et al,:Production of Alginate by Azotobacter vinelandii in semi - industrial scale using batch and fed - batch cultivation systems. J Adv SciRes, 2012, 3(4):45-50.
9. L.F. Dos Santos, F.C. Bazani Cabral De Melo, W.J. Martins Paiva, D. Borsato, M.D.L. Corradi Custodio Da Silva, M.A. Pedrine Colabone Celligoi: Characterization and optimization of Levan production by Bacillus subtilis NATTO. Romanian Biotechnological Letters, 18 (4) (2013), pp. 8413–8422.
10. Senni, Karim et al. “Marine Polysaccharides: A Source of Bioactive Molecules for Cell Therapy and Tissue Engineering.” Marine Drugs 9.9 (2011): 1664–1681. PMC. Web. 10 Mar. 2015.





