Anna Szpitter, Aleksandra Królicka
Zakład Ochrony i Biotechnologii Roślin, Katedra Biotechnologii, Międzyuczelniany Wydział Biotechnologii UG i GUMed Uniwersytet Gdański
strony wersji drukowanej: 16-22
strony wersji drukowanej: 16-22
Fenomen komórki roślinnej – totipotencja
Uważa się, że początkiem rozwoju tzw. „zielonej” biotechnologii była teoria totipotencji zaproponowana w 1902 roku przez austriackiego uczonego Gottlieb’a Haberlandt’a. Według tej teorii każda żywa komórka roślinna odłączona od korelacyjnego wpływu innych komórek, na specjalnych pożywkach, posiada zdolność do odtworzenia dowolnej tkanki, organu czy kompletnego organizmu. Od tamtej pory stopniowo zaczęto doskonalić technikę hodowli roślin w warunkach in vitro (łac. w szkle), pozwalającą na kontrolowanie rozwoju rośliny poprzez dobór odpowiedniego składu pożywki, na której w warunkach aseptycznych prowadzona jest hodowla w fitotronie (Fot. 1).

Fot. 1. Fitotron – pomieszczenie do hodowli roślin in vitro.
Fragmenty tkanek roślinnych (zwane eksplantatami) podatne są na działanie egzogennych regulatorów wzrostu jak auksyny czy cytokininy, które w znacznym stopniu decydują o kierunku rozwoju komórek roślinnych w hodowli in vitro. Tę właściwość wykorzystano w technologii mikrorozmnażania, polegającej nastymulowaniu rozwoju pąków czy pojedynczych komórek w kompletne rośliny (Fot. 2).

Fot. 2. Kultura in vitro Dionaea muscipula.
Według teorii Haberlandt’a każda żywa komórka roślinna posiada teoretycznie taką zdolność, więc łatwo sobie wyobrazić potencjał jaki drzemie w niewielkim fragmencie blaszki liściowej czy łodygi. Dodatkowo istnieje możliwość indukcji tworzenia tkanki przyrannej zwanej kalusem (Fig. 1), będącą niezorganizowaną masą komórek o wysokim tempie podziałów, która po odpowiedniej stymulacji regulatorami wzrostu może stać się źródłem zarodków, a następnie całych roślin.
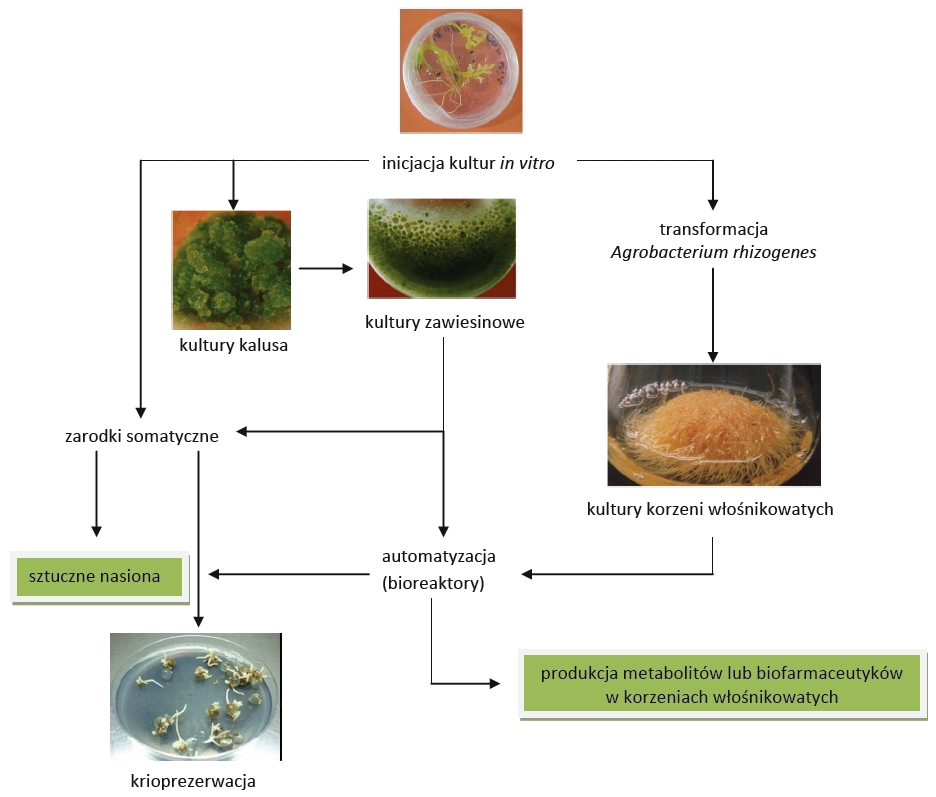
Fig 1. Wykorzystanie „zielonej” biotechnologii.
Mimo wysokich kosztów, technologia mikrorozmnażania posiada wiele zalet w porównaniu z tradycyjnymi metodami propagacji roślin, pozwalając na otrzymanie niezależnie od warunków klimatycznych dużej liczby roślin jednorodnych genetycznie i wolnych od patogenów. Metoda mikropropagacji znalazła zastosowanie w rozmnażaniu wielu gatunków roślin, których tradycyjna produkcja jest niezwykle trudna. Przykładem są tutaj niektóre rośliny ozdobne np. storczyki oraz drzewa leśne, a także elitarne odmiany roślin użytkowych np. truskawki, maliny. Ponadto technika rozmnażania i hodowli in vitro z powodzeniem stosowana jest do namnażania i reintrodukcji do środowiska roślin zagrożonych wyginięciem z powodu nadmiernej eksploatacji przez człowieka (storczyki, rośliny owadożerne).
Sztuczne nasiona
Aby namnożony materiał roślinny wysokiej jakości można było w prosty sposób przechowywać oraz wprowadzać do tradycyjnej hodowli „na polu” stosuje się technikę tworzenia sztucznych nasion. Do tego celu najczęściej wykorzystuje się otrzymane w kulturach in vitro zarodki somatyczne, które zwykle poddaje się otoczkowaniu i suszeniu. Obecnie trwają badania nad udoskonaleniem metod tworzenia sztucznych nasion tak, aby ich odporność na przechowywanie i zdolność do rozwoju w prawidłowe rośliny była zbliżona do nasion naturalnych. W tym celu stosuje się m.in. otoczki wzbogacane w inhibitory kiełkowania, sole mineralne, pestycydy czy też korzystne dla rozwoju zarodka mikroorganizmy. Poza zastosowaniem w rolnictwie, odpowiednio przygotowane sztuczne nasiona roślin zagrożonych wyginięciem mogą być poddane krioprezerwacji (Fig. 1) i przechowywane przez długi czas w głębokim zamrożeniu w bankach germplazmy.
Roślina jako fabryka cennych substancji
Od starożytności człowiek skwapliwie wykorzystywał właściwości lecznicze roślin. Cenione właściwości roślin wynikają z obecności w ich tkankach związków zwanych metabolitami wtórnymi, które biorą udział w interakcji roślin ze środowiskiem. Produkowane są one przez rośliny w celu obrony przed promieniowaniem UV, patogenami, roślinożercami, czy umożliwiają konkurencję z innymi gatunkami roślin. Wiele z ponad 100 000 do tej pory zidentyfikowanych roślinnych metabolitów wtórnych jest stosowanych w przemyśle farmaceutycznym czy kosmetycznym. Szacuje się, że 25% leków będących w użytku w krajach rozwiniętych stanowią związki pochodzenia roślinnego. Ponieważ synteza chemiczna wielu z metabolitów roślinnych jest niezwykle trudna i kosztowna, główną metodą ich otrzymywania pozostaje ekstrakcja tych związków z materiału roślinnego. Takie rozwiązanie niesie ze sobą szereg trudności, takich jak niska wydajność biosyntezy czy niewielkie stężenia pożądanych związków w tkance roślinnej. Dodatkowo wiele metabolitów wtórnych wykazujących aktywność biologiczną produkowanych jest przez gatunki zagrożone wyginięciem. W związku z tymi ograniczeniami tradycyjnego pozyskiwania materiału roślinnego atrakcyjną alternatywę stanowi produkcja z zastosowaniem roślinnych kultur komórkowych lub tkankowych. Jednym z pierwszych związków, który na skalę przemysłową otrzymano tą metodą był wykazujący działanie przeciwnowotworowe naftochinon – szikonina. Związek ten pozyskiwany jest z komórek Lithospermum erythrorizon hodowanych w postaci zawiesiny w bioreaktorach o pojemności 750 litra. Innym przykładem jest paklitaksel, alkaloid o aktywności przeciwnowotworowej wyizolowany z kory Taxus brevifolia, który stosowany jest w leczeniu raka piersi, jajników czy mięsaka Kaposiego. Paklitaksel produkowany jest w roślinie w tak niewielkim stężeniu, że leczenie jednego pacjenta wymaga zniszczenia co najmniej sześciu 100-letnich drzew. Paklitaksel pozyskiwany był ze źródeł naturalnych od czasu odkrycia w 1967 aż do 1993 roku, kiedy to rozpoczęto alternatywną produkcję tego chemioterapeutyku w hodowli in vitro komórek T. brevifolia na skalę przemysłową.
Transformacja roślin przy użyciu bakterii
Roślinne kultury zawiesinowe (Fig. 1) są stosowane często w produkcji metabolitów roślinnych na skalę przemysłową z powodu swej jednorodności oraz istnienia opracowanych metod hodowli w bioreaktorach o dużej pojemności. Problemem w przypadku tego typu kultur jest zwykle niestabilność genetyczna, niska wydajność produkcji, a także akumulacja wielu związków w wakuolach komórkowych, co sprawia że aby je „wydobyć” z komórek, konieczna jest likwidacja hodowli. Jedną z metod pozwalających na uzyskanie wyższego poziomu roślinnych metabolitów wtórnych w kulturach in vitro jest wykorzystanie bakterii z rodzaju Agrobacterium. Są to Gram ujemne patogeny wielu roślin dwuliściennych. W trakcie infekcji bakterie z rodzaju Agrobacterium wprowadzają do komórek rośliny (gospodarza) fragment DNA plazmidowego, który zawiera geny kodujące enzymy biorące udział w syntezie roślinnych regulatorów wzrostu oraz opin, stanowiących źródło węgla dla bakterii. W wyniku transformacji komórki roślinne w miejscu infekcji rosną i dzielą się intensywnie, co prowadzi do utworzenia narośli mającej postać guza lub „brody korzeniowej”, w zależności od gatunku infekującej bakterii (Fig. 2).
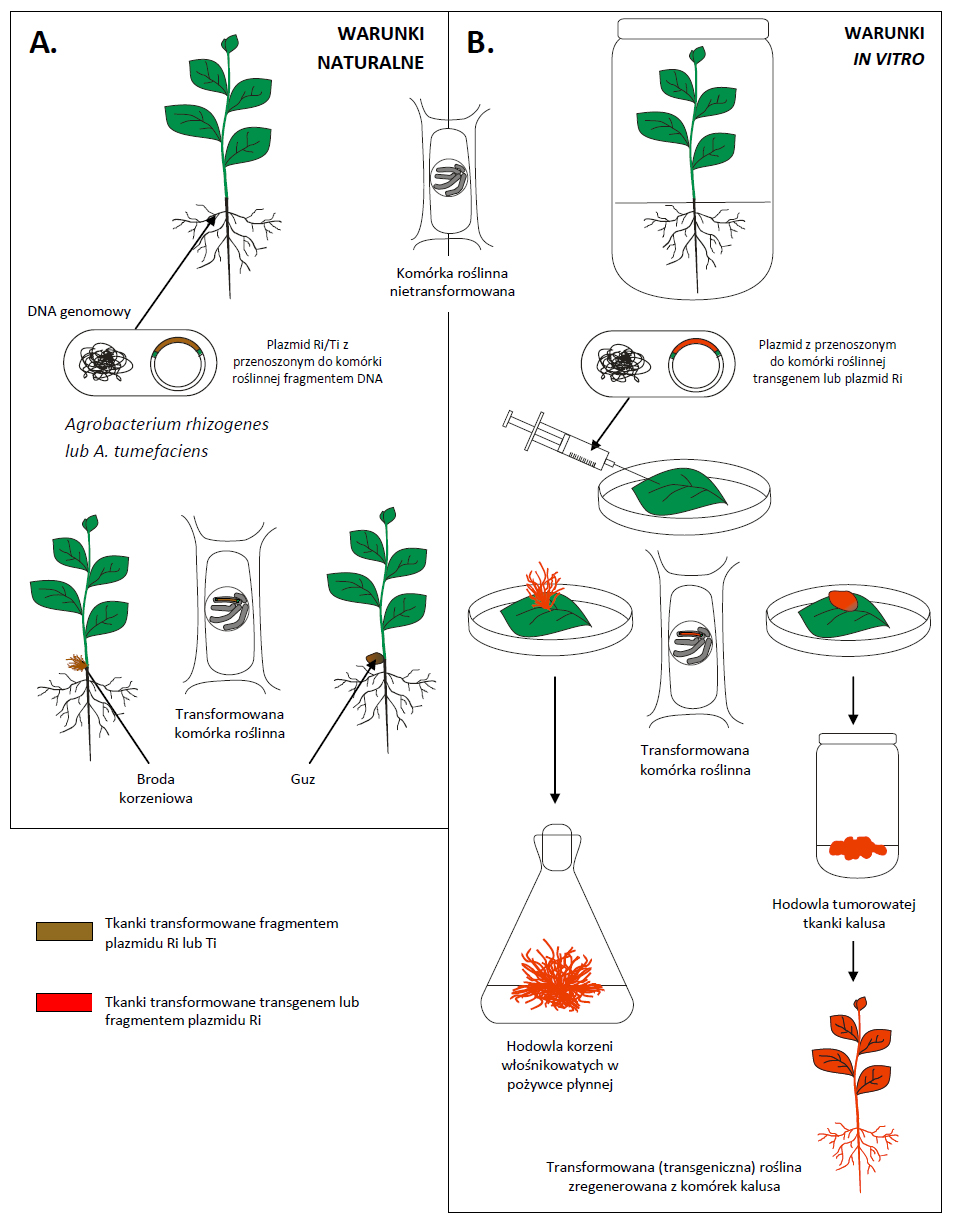
Fig 2. Transformacja roślin w warunkach naturalnych przez bakterie z rodzaju Agrobacterium oraz zastosowanie tego procesu w kulturach in vitro.
A. W warunkach naturalnych w wyniku infekcji przez Agrobacterium rhizogenes lub A. tumefaciens do genomu komórek roślinnych przenoszony jest odpowiednio - fragment plazmidu Ri lub Ti. W rezultacie tkanka ulega rozrostowi i tworzą się narośla w postaci brody korzeniowej lub tumorów.
B. W kulturach in vitro fragmenty roślin transformowane są za pomocą dzikich szczepów A. rhizogenes lub zmodyfikowanych genetycznie szczepów obu gatunków, które posiadają transgen(y) we fragmencie plazmidu przenoszonym do komórki roślinnej. W wyniku transformacji otrzymuje się kultury korzeni włośnikowanych lub rośliny transgeniczne.
O ile w rolnictwie czy sadownictwie choroby wywoływane przez Agrobacterium spp. są przyczyną wielu strat, to w roślinnych kulturach in vitro bakterie te stanowią bardzo użyteczne narzędzie w ręku biotechnologa. Przykładem może być wykorzystanie procesu transformacji roślin w kulturach in vitro do produkcji metabolitów wtórnych. W tym przypadku wykorzystuje się szczepy Agrobacterium rhizogenes. W wyniku procesu transformacji, w miejscu infekcji następuje intensywny wzrost licznych, drobnych korzeni zwanych korzeniami włośnikowatymi (Fig. 1, 2). Korzenie takie charakteryzuje niezwykle szybki i nieograniczony wzrost na pożywkach bez dodatku regulatorów wzrostu. Ponadto kultury korzeni włośnikowatych charakteryzuje znaczne zróżnicowanie komórek w porównaniu z hodowlą zawiesinową, co sprzyja zwiększonej produkcji niektórych metabolitów roślinnych. Dodatkowe podwyższenie poziomu produkowanych związków jest możliwe dzięki zastosowaniu transgenicznych szczepów A. rhizogenes, które w fragmencie wprowadzanym do komórki roślinnej posiadają gen/y kodujące enzymy biorące udział w szlakach metabolicznych wielu ważnych metabolitów wtórnych. Tą metodą dzięki wprowadzeniu genu 6-β-hydroksylazy pochodzącego z Hyoscymus muticus otrzymano kulturę korzeni włośnikowatych Atropa belladonna o wysokiej zawartości hioscyjaminy. W zastosowaniu korzeni włośnikowatych na skalę przemysłową problem jest technologia hodowli tych kultur. Prowadzone są prace nad zastosowaniem specjalnych bioreaktorów, w których korzenie umieszczone na specjalnych siatkach lub drutach, a pożywka dostarczana jest w postaci mgły.
Podwyższanie poziomu metabolitów wtórnych w kulturach in vitro
Wykorzystując fakt, że produkcja metabolitów wtórnych jest zwykle odpowiedzią rośliny na czynnik stresowy, do poprawienia produktywności kultur roślinnych stosuje się zabieg elicytacji. Polega on na traktowaniu kultur roślinnych elicytorami, czyli związkami lub czynnikami fizykochemicznymi takimi jak: metale ciężkie, promieniowanie UV, enzymy czy składniki ścian komórkowych bakterii i grzybów. W rezultacie w komórkach roślinnych indukowane są szlaki syntezy metabolitów wtórnych mających na celu neutralizację zewnętrznego zagrożenia. Przykładem skutecznego elicytora jest chitozan, pochodna chityny wchodząca w skład ścian komórkowych grzybów oraz kutikuli stawonogów. Poza stymulacją syntezy wielu metabolitów wtórnych należących do naftochinonów, alkaloidów czy terpenoidów posiada on własności polikationitu, przez co wpływa na przepuszczalność błon komórkowych, zwiększając wydzielanie produktów na zewnątrz komórek. Do innych zabiegów technologicznych pozwalających zwiększyć wydajność produkcji w kulturach in vitro należy metoda immobilizacji komórek. Unieruchomienie zawiesiny komórkowej na nośnikach takich jak alginian wapnia, wata szklana czy włókna bawełniane zwiększa zagęszczenie komórek, przez co imitowane są warunki panujące w tkance roślinnej. Komórki immobilizowane są dużo bardziej odporne na stres mechaniczny, dzięki czemu wydłuża się czas kultury i produkcji.
Szlaki syntezy wielu ważnych metabolitów wtórnych są wieloetapowe, a biorące w nich udział enzymy katalizują reakcje z różną wydajnością. Wprowadzenie do pożywki hodowlanej prekursora lub intermediatu szlaku metabolicznego, który wytwarzany jest w komórce na niskim poziomie może pozytywnie wpłynąć na zawartość produktu końcowego. Do często stosowanych prekursorów należą: L- fenyloalanina, kwas ferulowy i kwas cynamonowy, należące do szlaku syntezy fenylopropanoidów, który stanowi źródło szeregu roślinnych metabolitów wtórnych. Na wydajność poszczególnych etapów syntezy metabolitów wtórnych ma także wpływ gromadzenie w komórce produktu końcowego, bardzo często toksycznego w wysokich stężeniach. Podwyższony poziom metabolitów wtórnych hamuje ich syntezę w komórce na zasadzie sprzężenia zwrotnego lub stymuluje ich degradację enzymatyczną. Aby przeciwdziałać tym negatywnym efektom oraz ułatwić odzyskiwanie produktu z hodowli roślinnej dodaje się do pożywki żywice jonowymienne (np. Amberlite), na których powierzchni adsorbowane są metabolity wtórne uwolnione poza komórkę. Dzięki temu równowaga szlaków metabolicznych przesuwa się w kierunku syntezy, a jednocześnie produkt łatwo odzyskiwany z wymiennika, poddawany jest wstępnemu oczyszczeniu. Przykładem skutecznego zastosowania polimerowego adsorbentu w kulturach roślinnych jest użycie ciągłej recyrkulacji pożywki przez kolumnę wypełnioną żywicą jonowymienną w hodowli zawiesinowej komórek Duboisia leichardtii powodujące wzrost sekrecji oraz pięciokrotne zwiększenie produkcji alkaloidu - skopolaminy.
Rośliny w kulturach in vitro posiadają zdolność do enzymatycznego przekształcania związków podanych egzogennie do podłoża hodowlanego. Umożliwia to otrzymanie z wysoką wydajnością wielu metabolitów występujących na bardzo niskim poziomie lub zupełnie nowych związków nie występujących w naturze. Zastosowanie komórek roślinnych umożliwia wieloetapowe przekształcenie substratów, a także gwarantuje regio- i stereo specyficzność przeprowadzanych reakcji. Kultury zawiesinowe Stewia rebaudiana i Digitalis purpurea są wykorzystywane do przekształcania diterpenu stewiolu do jego glukozydów – stewiozydu i stewiobiozydu, związków 100-krotnie słodszych niż cukier trzcinowy. Niezróżnicowane komórki Digitalis lanata mogą przeprowadzać liczne reakcje modyfikacji egzogennych glikozydów kardenolidowych, mimo iż nie są one zdolne do produkcji żadnego z tych związków. Przykładem jest hydroksylacja digitoksygeniny w hodowli zawiesinowej D. lanata, w wyniku której otrzymuje się digoksygeninę – lek nasercowy o dużo niższej toksyczności niż substrat.
Biofarmaceutyki
Poza zainteresowaniem roślinnymi metabolitami wtórnymi jako źródłem leków, istnieje rosnące zapotrzebowanie na wysoko przetworzone produkty naturalne zwane biofarmaceutykami. Należą do nich preparaty stosowane do celów diagnostycznych, w lecznictwie (np. leki hormonalne) i profilaktyce (np. antygeny wirusowe wchodzące w skład szczepionek). Biofarmaceutyki, których większość stanowią białka, wykazują zwykle wysoką skuteczność w działaniu. Niestety preparaty takie produkowane w komórkach bakteryjnych są zwykle nieaktywne z powodu braku modyfikacji posttranslacyjnych charakterystycznych dla organizmów wyższych. Alternatywą jest wykorzystanie eukariotycznych systemów ekspresji w postaci hodowli komórek owadzich czy zwierzęcych, jak również transgenicznych zwierząt. Takie rozwiązania niosą jednak ze sobą bardzo wysokie koszty, a także, w przypadku modyfikowanych zwierząt, problemy natury etycznej i prawnej. Ponadto w systemach zwierzęcych istnieje ryzyko przeniesienia wraz z produktem białkowym groźnych dla ludzi patogenów jak wirus zapalenia wątroby typu C czy priony. Z tego względu zastosowanie transgenicznych roślin do produkcji biofarmaceutyków na dużą skalę wydaje się być obiecującym rozwiązaniem. W systemie tym produkcja biomasy jest bardzo ekonomiczna, a oczyszczanie produktu białkowego często może być ominięte, jak to ma miejsce w przypadku roślin jadalnych produkujących białka szczepionkowe. Rewolucję jakiej dokonało wprowadzenie roślinnych systemów ekspresyjnych do produkcji biofarmaceutyków obrazuje fakt, iż technologia ta spowodowała spadek ceny 1 kg przeciwciał monoklonalnych z 3 mln $ do około 100 $. Do tej pory uzyskano wiele roślin transgenicznych produkujących szereg białek ludzkich, antygenów wirusowych czy przeciwciał. Spośród tych produktów najbliższe wprowadzeniu na rynek jest produkowane w roślinach tytoniu przeciwciało skierowane przeciwko Streptococcus mutans – bakterii powodującej próchnicę. Ponadto zaawansowane testy kliniczne prowadzone są na antygenach wirusa HBV oraz wścieklizny, wytwarzanych w roślinach ziemniaka i szpinaku w celu zastosowania ich jako szczepionek jadalnych.
Jak ulepszyć pomidora i pozbyć się rtęci z gleby?
Jedną z ważniejszych gałęzi „zielonej” biotechnologii jest ulepszanie właściwości odmian uprawnych. W przeciwieństwie do tradycyjnych metod hodowli wykorzystujących krzyżowanie roślin i selekcję, obecnie dysponujemy licznymi narzędziami umożliwiającymi usprawnienie oraz większą kontrolę tego procesu. Jedną z nich jest tworzenie odmian transgenicznych poprzez wprowadzenie genu z innego gatunku lub modyfikację stopnia ekspresji genu istniejącego. Do tej pory otrzymano liczne odmiany roślin użytkowych posiadające przewagę nad tradycyjnymi wariantami w zakresie odporności na patogeny, pestycydy, tolerancji na metale ciężkie czy jakości otrzymywanego produktu. Pierwszą zmodyfikowaną genetycznie rośliną, wprowadzoną na rynek w 1994 roku, była odmiana pomidora o nazwie „FlavrSavr”, o obniżonej aktywności genu kodującego pektynazę, co skutkowało spowolnionym procesem dojrzewania owoców i umożliwiło wydłużenie okresu ich przechowywania. Obecnie większość areału upraw transgenicznych na świecie zajmują rośliny posiadające cechy odporności na herbicydy o szerokim spektrum takie jak Roundoup (glifosat), a także, odporności na owady dzięki obecności genu kodującego toksyczne białko Cry pochodzącego z bakterii Bacillus thuringensis. Ponadto prowadzone są badania nad odmianami o zmodyfikowanej zawartości skrobi, mikroelementów, witamin, a także o obniżonej zawartości kofeiny czy białek alergennych. Transgeniczne rośliny tworzą również obiecującą perspektywę dla fitoremediacji, procesu polegającego na wykorzystaniu roślin do usuwaniu szkodliwych związków ze środowiska. Najczęściej stosowane są do tego celu geny pochodzące z mikroorganizmów, które są naturalnie zdolne do degradacji toksyn lub redukcji jonów metali ciężkich. Dzięki wprowadzeniu zmodyfikowanego genu MarA z Escherichia coli kodującego reduktazę rtęciową do genomu Arabidopsis thaliana oraz Populus sp., rośliny te uzyskały zdolność do redukcji jonów rtęci obecnych w glebie do rtęci metalicznej uwalnianej następnie do atmosfery.
Ponieważ odporność roślin na abiotyczne czynniki stresowe takie jak susza czy zasolenie jest cechą warunkowaną przez liczne procesy metaboliczne, otrzymanie odmiany odpornej za pomocą modyfikacji pojedynczych genów jest niezwykle trudne. W tym celu można zastosować proces selekcji w roślinnych kulturach in vitro, a warunkiem jej skuteczności jest istnienie zmienności w obrębie puli testowanych genotypów. Roślinne kultury kalusa czy zawiesiny komórkowej charakteryzują się wysokim poziomem mutacji spontanicznych, niespotykanym w warunkach naturalnych w roślinach, wynikających głównie z szybkiego tempa podziałów komórkowych. Traktując kulturę kalusa Cuccumis sativus filtratem z kultury grzyba Fusarium oxysporum uzyskano odmianę odporną na tego patogena, natomiast hodowla kalusa Nicotiana tabacum na pożywce zawierającej wysokie stężenie NaCl umożliwiła wyselekcjonowanie roślin odpornych na zasolenie. Dodatkowo, aby zwiększyć zmienność w kulturze in vitro, a tym samym poprawić wydajność selekcji, stosuje się mutagenezę z użyciem czynników fizycznych (np. promieniowanie UV) lub chemicznych (np. nitrozo -guanidyna). Inną metodą pozwalającą na tworzenie nowych odmian roślin o unikatowych kombinacjach cech jest hybrydyzacja somatyczna. Technika ta polega na enzymatycznym usunięciu ścian komórkowych z komórek roślinnych, a w dalszym etapie na fuzji tak wyizolowanych protoplastów z różnych odmian lub gatunków. W ten sposób otrzymywane są mieszańce posiadające nowe kombinacje genomów jądrowych oraz cytoplazmatycznych (chloroplastów i mitochondriów) np. nowe odmiany Brassica napus odporne na patogeny grzybowe czy nicienie, a powstałe w wyniku hybrydyzacji B. napus z protoplastami innych gatunków.
Wszystkie wspomniane wyżej modyfikacje roślin w celu otrzymania odmian użytkowych czy też produkcji biofarmacetyków nie byłyby możliwe do osiągnięcia bez opracowania wydajnych metod modyfikacji genomu roślinnego. Jedną z często stosowanych technik jest wprowadzanie transgenów do komórek roślinnych z użyciem wspomnianych już bakterii z gatunku Agrobacterium jako wektorów. Szczepy wykorzystywane do transformacji posiadają zmodyfikowany plazmid Ti, w którym interesujący gen wraz z genem umożliwiającym selekcję umieszczone są w rejonie przenoszonym do komórki w trakcie infekcji. Innym wektorem do transformacji są zmodyfikowane wirusy roślinne np. wirus mozaiki tytoniu, stosowane do indukowania przejściowej ekspresji transgenu w rozwiniętych roślinach. Modyfikacji genomu roślinnego można także dokonać za pomocą metod bezwektorowych takich jak transformacja roślinnych protoplastów z użyciem elektroporacji czy glikolu polietylenowego, a także coraz powszechniej stosowane mikrowstrzeliwanie polegające na wprowadzaniu do komórek mikronośników opłaszczonych DNA. Zaletą techniki mikrowstrzeliwania jest możliwość wprowadzania transgenu do organelli komórkowych, a także stosowania jej praktycznie do wszystkich typów tkanek.
Człowiek od wieków zależał od roślin, które stanowiły źródło pożywienia, budulec, a także źródło leków, natomiast dynamiczny przyrost liczby ludności oraz zmiany kulturowe wymusiły zmiany w podejściu do wykorzystania tej części zasobów naturalnych. Rozwój najnowszej biotechnologii umożliwia zmniejszenie negatywnego wpływu na środowisko pochodzącego z intensyfikacji produkcji rolnej wynikające z odpowiedniego kształtowania predyspozycji genetycznych hodowanych odmian. Osiągnięcia tej dziedziny pozwalają także na pełniejsze wykorzystanie potencjału roślin w takich gałęziach gospodarki jak przemysł farmaceutyczny czy kosmetyczny.





