Wojciech Mrozik
Gdański Uniwersytet Medyczny
strony wersji drukowanej: 20-21
strony wersji drukowanej: 20-21
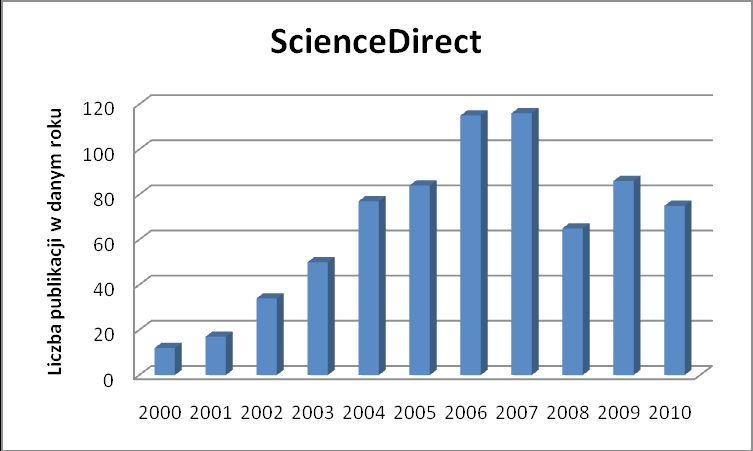
Ostatnia dekada przyniosła wzrost zainteresowania technikami analitycznymi i separacyjnymi wykorzystującymi nowy typ wypełnień tzw. złoża monolityczne. Tego typu wypełnienie, zastosowane w formie kolumn do HPLC czy kapilar w elektroforezie kapilarnej, z powodzeniem wykorzystano w analizie leków, metabolitów, hormonów czy w badaniach środowiskowych [1-5]. Dodatkowo, złoża monolityczne doskonale sprawdziły się też jako np. dyski ekstrakcyjne na etapie oczyszczania i separacji badanych analitów z różnych matryc środowiskowych [6]. Na wykresie 1 zaprezentowano ilość rekordów w latach 2000- 2010 - zarejestrowanych w bazie danych ScienceDirect przy wyszukiwaniu hasła monolithic column – w zakresie Tytułu, Abstraktu oraz Słów Kluczowych.
Głównym czynnikiem limitującym zastosowanie kolumn monolitycznych np.: w rutynowych analizach farmaceutycznych, są przede wszystkim obowiązujące procedury, które są opracowane przy wykorzystaniu konwencjonalnych wypełnień. Według Farmakoei Europejskiej na kolumnach monolitycznych bada się trzy substancje na około 3000 monografii. Olbrzymią wadą kolumn monolitycznych jest niska dostępność. Na rynku są kolumny zaledwie dwóch firm, Mercka (kolumna Chromolith) oraz Phenomenex (kolumna Onyx). W przeciwieństwie do konwencjonalnych kolumn, upakowanych ziarnami sorbentu, kolumny monolityczne to ciągły i jednorodny materiał, w którego strukturze występują pory. W przypadków porów w monolicie mamy do czynienia z dwoma ich typami mezo- i makroporami. Mezopory stanowią „główną powierzchnię oddziaływań” a więc determinują sprawność i pojemność kolumny [7]. Makropory natomiast łącza się ze sobą tworząc rozległa sieć kanałów, w której porusza się faza ruchoma [2, 8-10]. W trakcie syntezy można regulować ilość mezo- i makroporów poprzez dobór odpowiednich porogenów i warunków reakcji.
Produkcja kolumn monolitycznych opiera się o albo o wykorzystanie nieorganicznych polimerów (krzemionka) lub organicznych polimerów (polistyren) [1, 10-14]. Metoda wytworzenia monolitu krzemionkowego polega na hydrolizie, głównie silanu z dodatkiem glikolu polietylenowego – jako porogenu. Jako wynik polikondensacji otrzymywane są: monolityczna masa z porami albo wytrącone ziarna krzemionki (w zależności od warunków prowadzenia reakcji). Duża zaletą monolitów jest możliwość modyfikacji ich powierzchni w trakcie syntezy (np.: dodając ugrupowania alifatyczne oktadecylowe czy ortylowe po etapie suszenia). Aby nadać odpowiedni kształt monolitom, reakcje prowadzi się bezpośrednio w odpowiednich tubach lub kapilarach. Pozwala to uzyskiwać kształty od bardzo długich kapilar poprzez, klasyczne kolumny chromatograficzne do dysków ekstrakcyjnych. W przypadku produkcji kolumn na bazie polimeru organicznego, do wyboru są dwa typy - hydrofobowy i hydrofilowy. Dodatkowo monolity organiczne mogą występować w dwóch formach strukturalnych: homogenicznego żelu lub sztywnego porowatego polimeru. Żel, ze względu na swoją przezroczystość, nadaje się jako medium separacyjne (odznacza się także wysoką porowatością oraz brakiem dyfuzji wirowej). Przykładem jest usieciowany poliakrylamid (PAA). Drugi typ struktury składa się z jednego kawałka wysoce usieciowanego polimeru z makroporami tworzącymi wewnętrzne kanały oraz odznacza się wysoką sztywnością. Niezależnie jednak od typu struktury, jako efekt końcowy możemy dokonać modyfikacji powierzchni i otrzymać odpowiednie fazy stacjonarne (C18, SCX, SAX, chiralne i in.) [1, 3, 10, 14]. W licznych porównaniach [8, 15- 23] kolumn tradycyjnych podobnych wymiarach, pakowanych z wypełnieniami monolitycznymi dowiedziono, że te drugie wykazują o wiele lepsza zdolność rozdziału szczególnie dużych biomolekuł, gdzie oferują wyższą selektywność. Dodatkowo można je bez przeszkód poddawać miniaturyzacji, co ma niebagatelne znaczenie w najnowszych technikach chromatograficznych sprzężonych z spektrometrami mas gdzie przepływy powinny być niskie oraz w typowych zestawach do mikro- lub nano-HPLC. Wadą jest jednak stosunkowo duże zużycie rozpuszczalników oraz ze względu na mniejszą powierzchnię kolumny charakteryzują niższą retencyjnością. Nie bez znaczenia jest też ich niższa pojemność (łatwiej przeładować kolumnę monolityczną). Monolityczne fazy dowiodły swojej przydatności w badaniach preparatów farmaceutycznych, zarówno poprzez analizę leków w badaniach klinicznych (leki i metabolity we krwi czy osoczu), aż do monitorowania leków oraz innych substancji chemicznych (np. pestycydów) w różnorakich matrycach środowiskowych. Stosowanie kolumn monolitycznych jest szczególnie wskazane do rozdziałów preparatywnych, gdyż wykazują wysoką liczbę półek teoretycznych w przeliczeniu na jednostkę oporu przepływu w kolumnie. W tabeli 1 zaprezentowano kilka przykładowych zastosowań kolumn monolitycznych w technikach chromatograficznych.
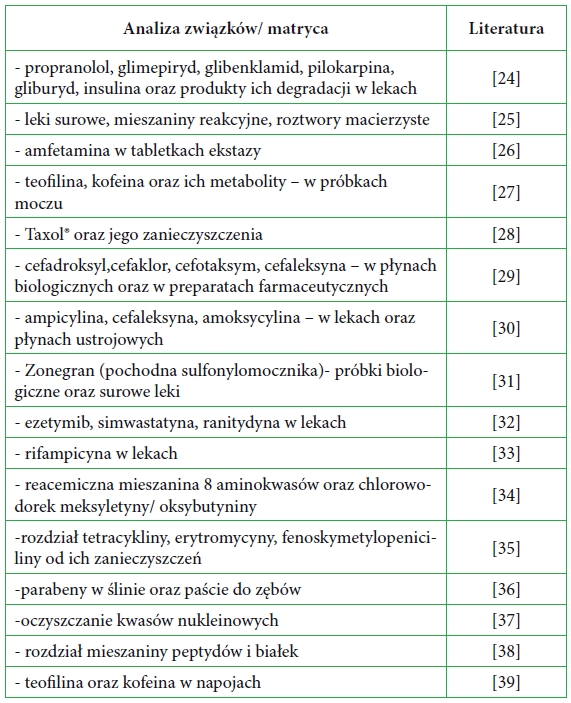
Tabela 1. Przykładowe zastosowania kolumn monolitycznych.