Na podstawie noty aplikacyjnej Dionex 234 opracował:
Rafał Bachorz
Polygen Sp. z o.o.
strony wersji drukowanej: 16-19
strony wersji drukowanej: 16-19
Wstęp
Peptydy mają istotne znaczenie w wielu procesach fizjologicznych takich jak przekazywanie sygnałów w komórkach. Wiele z nich zostało przebadanych pod kątem ich aktywności jako leki. Okazało się, że niektóre peptydy są odpowiedzialne za wazodilatację i wazokonstrykcję. Inne zaś to hormony i neuropeptydy. Analiza peptydów jest niezbędna w badaniach ich potencjalnego stosowania jako leki.
Oksytocyna jest neuropeptydem, który znalazł zastosowanie w stymulacji porodu, kontroli krwotoku poporodowego i stymulacji laktacji. Związek ten, będący dużą strukturą pierścieniową (rys. 1), posiada mostek dwusiarczkowy łączący dwie cząsteczki cysteiny. W postaci obojętnej oksytocyna jest stabilna w zakresie pH 3-5. W roztworach kwaśnych związek ten hydrolizuje, w roztworach obojętnych i zasadowych tworzy dimery i inne układy polimerowe. Dzieje się tak przez tworzenie międzymolekularnych mostków dwusiarczkowych co prowadzi do dezaktywacji peptydu.
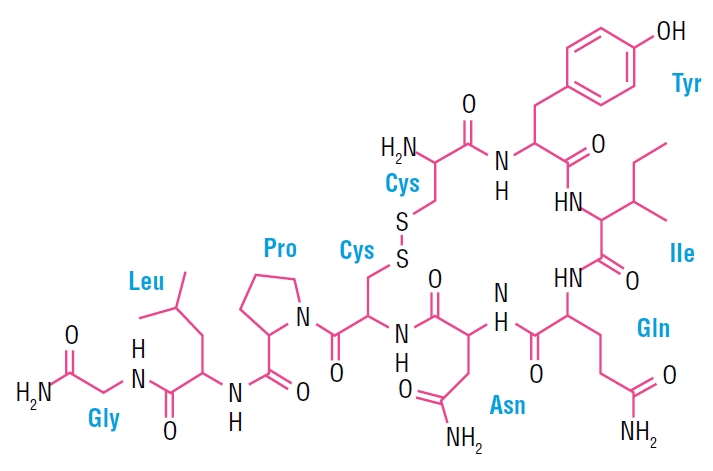
Rysunek 1. Struktura oksytocyny.
Oksytocyna jest dostępna jako sól octanowa. Amerykańska i europejska farmakopea (odpowiednio USP i EP) zezwalają na zawartość 6-10% (wagowo) kwasu octowego w składzie leku. Stosowanie jonu octanowego jako przeciwjonu w terapeutykach peptydowych jest często spotykane.
Farmakopea amerykańska i europejska sugerują stosowanie metody HPLC do oznaczania oksytocyny i jonu octanowego. Wersja USP wykorzystuje gradient buforu fosforanowego i acetonitrylu na kolumnie C18 z przepływem 1,5 ml/min. Cała analiza trwa 20 minut. Wersja EP jest bardzo podobna, ale przepływ wynosi 1,0 ml/min co wydłuża czas analizy do 30 minut. Metodyka oznaczania kwasu octowego w obu wersjach jest równoważna i sprowadza się do wykorzystania kolumny C18 oraz fazy ruchomej bufor fosforanowy/acetonitryl w gradiencie. Oznaczenie kwasu octowego zabiera 22 minuty przy przepływie 1,2 ml/min. Całkowite oznaczenie octanu oksytocyny zabiera przynajmniej 42 minuty z koniecznością przeprowadzenia dwóch niezależnych nastrzyków.
W niniejszym opracowaniu oksytocyna i jon octanowy rozdzielone zostały w pojedynczym nastrzyku. Wykorzystana została kolumna Acclaim® Mixed Mode WAX-1, która pozwala na dobrą retencję octanu i czas elucji oksytocyny równoważny kolumnie C18 co prowadzi do efektywnego oznaczenia obydwu związków w pojedynczym nastrzyku. Duże możliwości metody równoczesnego oznaczania peptydu i towarzyszącego octanu zilustrowane są przykładami oznaczenia octanu w czterech peptydach: oksytocynie, angiotensynie I, bradykininie i neurotensynie. Kolumna Mixed Mode WAX-1 z powodzeniem rozdziela rozważany peptyd, octan i inne zanieczyszczenia peptydowe w czasie poniżej 30 minut. W porównaniu do oryginalnej metody z farmakopei znacznie skrócony jest całkowity czas analizy, zmniejszona ilość rozpuszczalnika i odpadów.
W niniejszej aplikacji wykorzystany został zestaw do wysokosprawnej chromatografii cieczowej Dionex Ultimate 3000 składający się z: podstawki na rozpuszczalniki SRD-3200, pompy binarnej HPG-3200M, autosamplera WPS-3000TSL (wyposażonego w pętlę 25 µl), termostatu do kolumn TCC-3200, detektora UV-Vis VWD-3400RS (wyposażonego w celkę semi-micro 2,5 µl), oprogramowania chromatograficznego Chromeleon® 6.8.
Odczynniki
Woda dejonizowana 18 MΩ (lub lepsza), metanol jakości HPLC, fosforan potasu jakości HPLC, dziesięciowodny pirofosforan sodu, kwas fosforowy, bufory pH=4 i pH=7, lodowaty kwas octowy, chlorobutanol.
Próbki: Angiotensyna I (Sigma-Aldrich P/N A-9650), bradykinina (Sigma-Aldrich P/N B-3259), neurotensyna (Sigma-Aldrich P/N N-6383), oksytocyna (Sigma-Aldrich P/N O-6379).
Warunki rozdziału chromatograficznego

Wyniki i dyskusja
a) separacja
Rysunek 2 przedstawia rozdział octanu i oksytocyny w próbce peptydu na kolumnie Acclaim® Mixed Mode WAX-1. Odczyn pH fazy ruchomej został wyznaczony na wartość 4,2 po badaniach w zakresie 3-6. Stanowi to kompromis pomiędzy rozdzielczością, czasem retencji octanu i całkowitym czasem analizy. Przy niższych wartościach pH octan jest słabo zatrzymywany na kolumnie natomiast przy wyższych wartościach pH (blisko 6) rozdzielenie pomiędzy oksytocyną i jej peptydowymi zanieczyszczeniami jest niezadawalające. Przy optymalnym pH (4,2) piki oksytocyny i octanu są dobrze rozdzielone od zanieczyszczeń co pozwala na łatwą identyfikację oraz jakościowe i ilościowe oznaczenie. Przy 27 minucie widoczny jest pik pochodzący od nieznanego zanieczyszczenia, który nie jest obecny w referencyjnych danych z farmakopei. Całkowity czas analizy może być skrócony do 20 minut przy nieobecności tego zanieczyszczenia w badanej próbce.
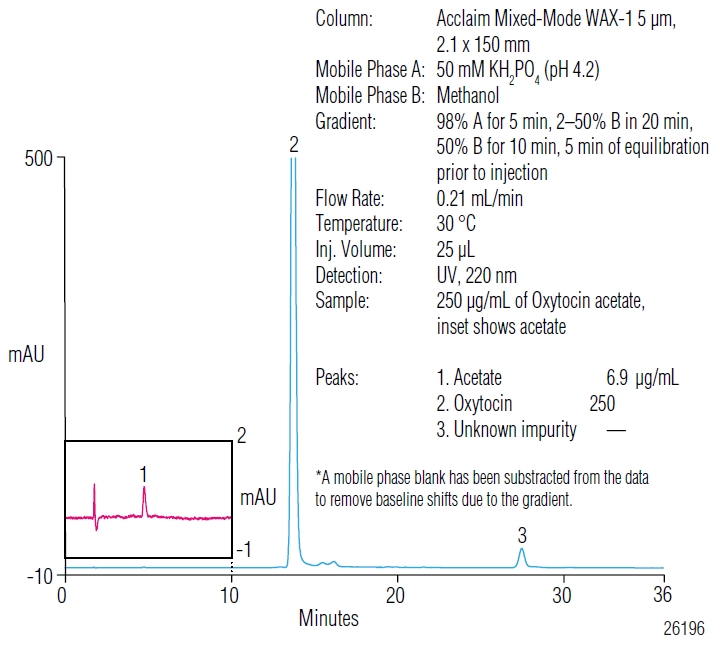
Rysunek 2. Rozdział octanu i oksytocyny na kolumnie Acclaim® Mixed-Mode (odjęty został sygnał fazy ruchomej w celu uniknięcia przesunięcia linii podstawowej).
Chlorobutanol jest często spotykanym konserwantem dozwolonym w roztworach oksytocyny przeznaczonych do zastrzyków. W celu potwierdzenia, że jego obecność nie koliduje z oksytocyną czy octanem, został on dodany do próbki. Chromatogram na rys. 3 pokazuje, że nie ma takiego zagrożenia a piki oksytocyny i chlorobutanolu są bardzo dobrze rozdzielone.
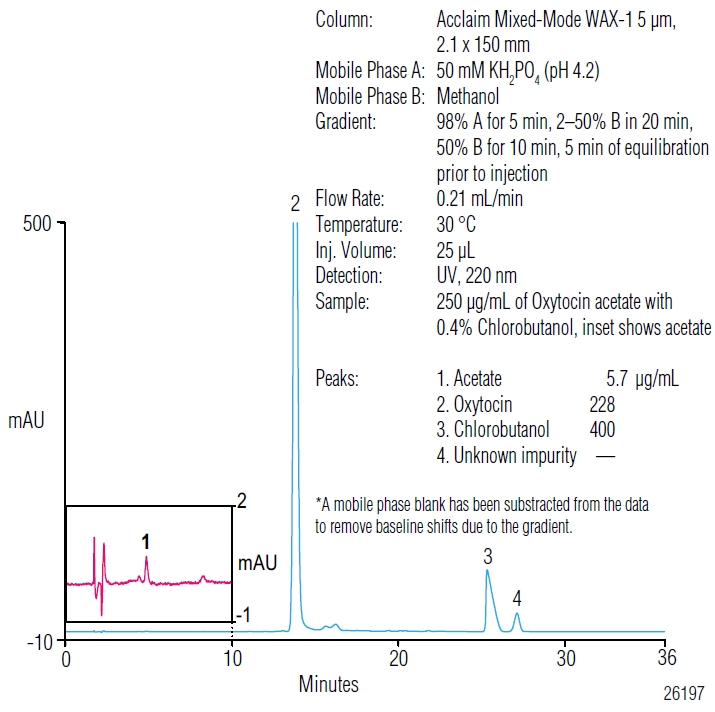
Rysunek 3. Rozdział octanu, oksytocyny i chlorobutanu na kolumnie Acclaim® Mixed-Mode (odjęty został sygnał fazy ruchomej w celu uniknięcia przesunięcia linii podstawowej).
b) Analiza jakościowa, liniowość, granica oznaczenia ilościowego (LOQ), granica wykrywalności (LOD)
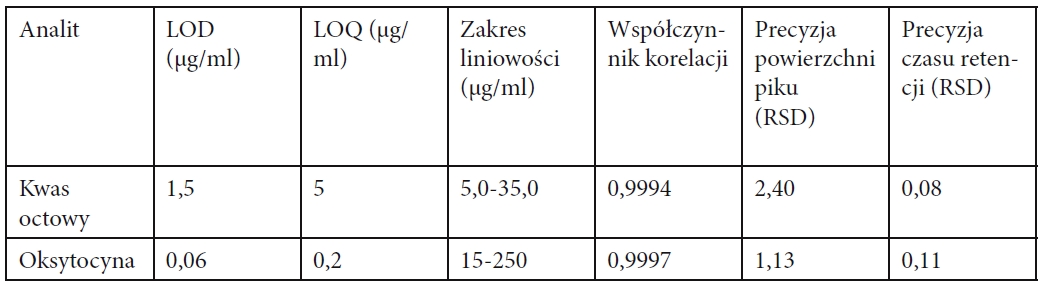
Oznaczenie oksytocyny przy zastosowaniu metod farmakopei europejskiej wymaga stężenia 250 µg/ml, amerykański odpowiednik zakłada 25 µg/ml przy założeniu że jej aktywność jest nie mniejsza niż 400 jednostek/mg. Badanie liniowości zostało przeprowadzone w zakresie 15 µg/ml do 250 µg/ml tak aby uwzględnić wartości z obydwu farmakopei. Wyznaczony współczynnik korelacji w tym zakresie wynosi 0,9997. Wartości LOD i LOQ zostały zmierzone przez nastrzyknięcie próbek, które dają odpowiedź 3- i 10-krotności wartości szumu. To dało wynik 0,06 µg/ml dla LOD i 0,2 µg/ml dla LOQ. Stężenie przeciwjonu octanowego w próbce peptydowej zmienia się znacznie w zależności od peptydu. Liniowość odpowiedzi octanu została zbadana w zakresie 5,0 do 35 µg/ml, co odpowiada oczekiwanemu zakresowi zawartości octanu w badanych peptydach. Wartości współczynnika korelacji, LOD i LOQ są zaprezentowane w tabeli 1.
Tabela 1. Granica wykrywalności, granica oznaczenia ilościowego, liniowość i precyzja w oznaczeniu octanu i oksytocyny.
c) Precyzja i dokładność analizy octanu w oksytocynie i innych peptydach.
Zawartość octanu w próbce oksytocyny jest niewielka. Można ją szacować na około 0,5 mola octanu przypadające na 1 mol peptydu. W przypadku innych peptydów wartość ta może sięgać aż 2,5 mola octanu przypadające na mol peptydu. W celu precyzyjnego wyznaczenia stężenia octanu w różnych peptydach próbki zostały przygotowane przez rozpuszczenie 250 µg w 1 ml rozpuszczalnika. W tabeli 2 przedstawione są wyznaczone zawartości octanu dla czterech rozważanych peptydów. W żadnym przypadkach względne odchylenie standardowe (RSD) powierzchni pików nie przekracza 2%, co jest znacznie poniżej 5% wymogu farmakopei.
Tabela 2. Oznaczenie octanu w próbkach czterech różnych octanów.
tab2.jpg
Wyznaczone zawartości octanu w próbkach peptydów dobrze zgadają się z wartościami sugerowanymi przez producenta. Stężenia nie różnią się o więcej niż 10% za wyjątkiem neurotensyny, gdzie wyznaczone stężenie przekracza o 17% oczekiwaną wartość.
Rysunek 4 przedstawia rozdział octanu i peptydu dla rozważanych próbek oksytocyny, angiotensyny I, neurotensyny i bradykininy. W każdym przypadku ilościowe oznaczenie peptydu i towarzyszącego jonu octanowego możliwe jest w pojedynczym nastrzyku. Rysunek 5 pokazuje powiększenie otoczenia pików pochodzących od jonów octanowych. Jak widać mogą one być bez trudu zintegrowane bez zakłóceń ze strony innych składników próbki.
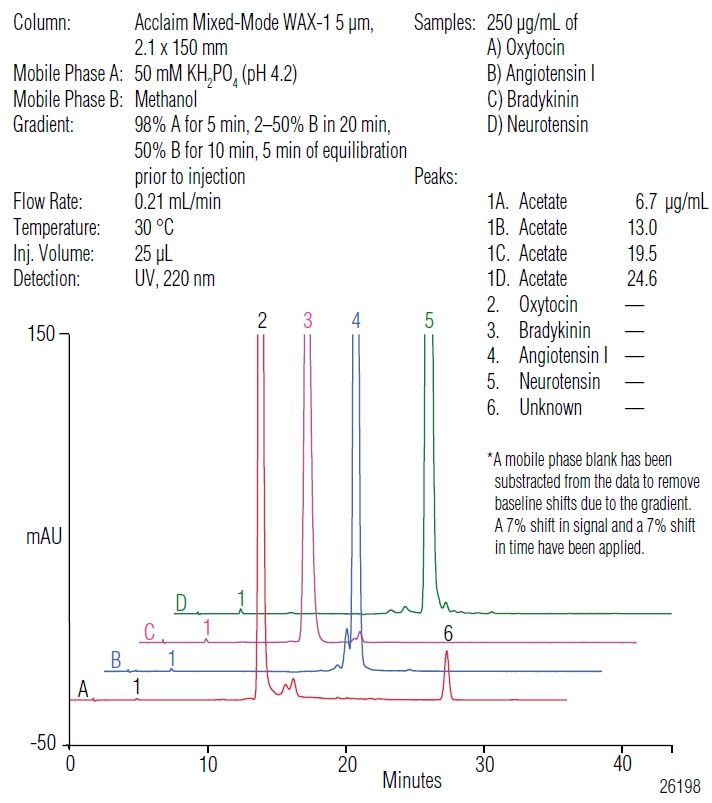
Rysunek 4. Oznaczenie octanu w próbce oksytocyny, angiotensyny I, bradykininy i neurotensyny (odjęty został sygnał czystej fazy ruchomej w celu uniknięcia przesunięcia linii podstawowej).
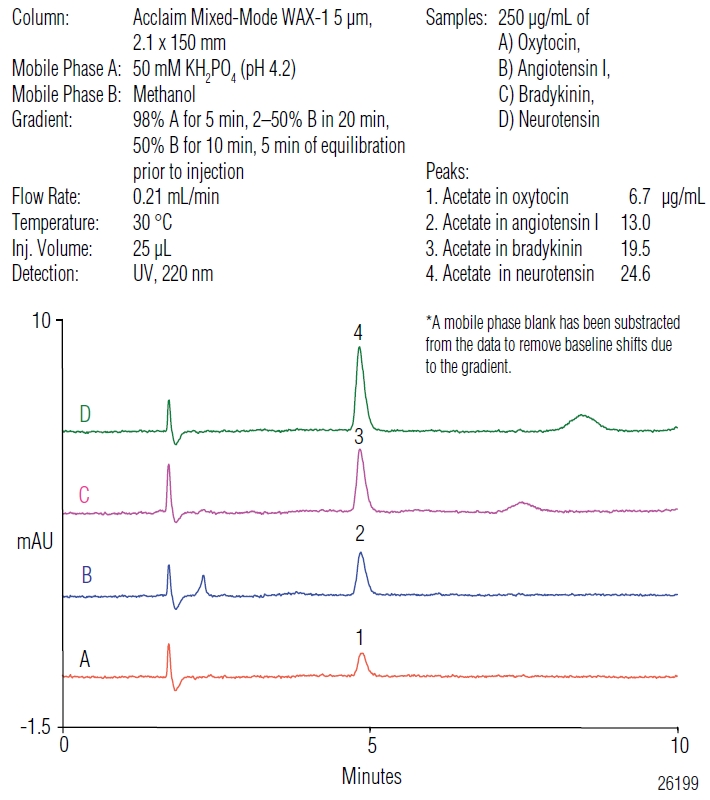
Rysunek 5. Powiększenie otoczenia piku pochodzącego od octanu (odjęty został sygnał czystej fazy ruchomej w celu uniknięcia przesunięcia linii podstawowej).
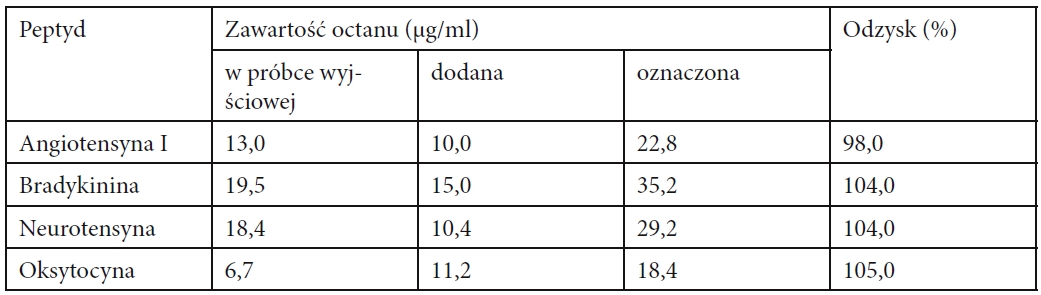
Odzysk octanu w czterech próbkach zbadany został przez dodanie kwasu octowego do roztworów peptydów. W przypadku neurotensyny zamiast kwasu octowego wykorzystana była jego sól sodowa. Dodanie kwasu octowego do roztwory neurotensyny prowadziło do niespodziewanych odzysków rzędu 128-132%. Prawdopodobnie zmiana pH spowodowała uwolnienie związanego octanu z peptydu. Odzyski wahają się w granicach 98-105% (tabela 3).
Tabela 3. Odzyski octanu w próbkach peptydów.
Wnioski
W niniejszej aplikacji przedstawiona została metoda oznaczania peptydu i towarzyszącego jonu octanowego w pojedynczym nastrzyku. Wykorzystany został zestaw do wysokosprawnej chromatografii cieczowej Dionex Ultimate 3000 i kolumna Acclaim® Mixed-Mode WAX-1. Metoda jest szybka, czuła i posiada wystarczającą czułość do oznaczania octanu w próbkach zawierających 250 µg/ml peptydu. Octan został z powodzeniem oznaczony w próbkach czterech różnych peptydów. Zastosowanie kolumny o średnicy wewnętrznej 2,1 mm oraz przeprowadzenie całej analizy w ramach pojedynczego nastrzyku oszczędza czas, zmniejsza pięciokrotnie zużycie rozpuszczalników (dla próbki oksytocyny) i znacznie zmniejsza ilość odpadów.






