Katedra i Zakład Chemii Nieorganicznej, Wydział Farmaceutyczny, Gdański Uniwersytet Medyczny

1. Streszczenie
Postęp w elektronice użytkowej, wraz z udoskonalaniem technik mikroprzepływowych, nanotechnologii i przetwarzania danych prowadzi do wprowadzania atrakcyjnych cenowo i przyjaznych dla użytkownika urządzeń przenośnych, które są w stanie pełnić nie tylko funkcje gadżetów ale i narzędzi diagnostycznych. Ponadto, opracowywane są liczne smart urządzenia, które monitorują stan zdrowia pacjenta, niektóre z nich znajdują faktyczne zastosowanie przy łóżku pacjenta (Point-of-Care – PoC), jako wiarygodne źródło oceny stanu zdrowia. Obecne praktyki diagnostyczne nadal bazują na testach laboratoryjnych, poprzedzonych pobraniem próbek biologicznych, po których następuje wykonanie w warunkach klinicznych odpowiednich testów przez wyszkolony personel, z użyciem specjalistycznego sprzętu. W rzeczywistości, pasywno/aktywne zbieranie danych fizjologicznych i behawioralnych w czasie rzeczywistym od pacjentów, zasilające modele sztucznej inteligencji (Aritificial Intelligence – AI), może znacznie usprawnić podejmowanie decyzji odnośnie diagnozy i procedury leczenia, poprzez pominięcie konwencjonalnych metod pobierania próbek i diagnostyki, z wyłączeniem również roli patologów. Połączenie konwencjonalnych i cyfrowych metod wykrywania biomarkerów, za pomocą przenośnych, autonomicznych i zminiaturyzowanych urządzeń, może zrewolucjonizować diagnostykę medyczną w nadchodzących latach, dlatego w poniższym artykule porównano tradycyjne praktyki kliniczne z nowoczesnymi technikami diagnostycznymi, opierającymi się na sztucznej inteligencji i uczeniu maszynowym (Machine Learning – ML). Przedstawione technologie „wychodzą” z laboratoriów i zaczynają być komercjalizowane, co w perspektywie powinno prowadzić do ulepszania obecnych narzędzi diagnostycznych lub ich zastępowania. Ich aplikacja np. w trybie przy-łóżku-pacjenta (PoC) lub jako technologia użytkowa dla każdego pacjenta staje się realną perspektywą i najbliższe lata zapowiadają zintensyfikowanie badań w tej tematyce.
2. Wstęp
Wysoka liczba zgonów wywołanych chorobami wieloczynnikowymi (nowotwory, choroby układu oddechowego, zaburzenia sercowo-naczyniowe i zakaźne) wynika przede wszystkim ze zbyt późnej diagnozy, co ogranicza skuteczne leczenie i znacznie podwyższa koszty opieki nad pacjentem. Globalny rynek opieki zdrowotnej obejmuje opiekę ambulatoryjną i stacjonarną prowadzoną przez lekarzy, stomatologów, szpitale, usługodawców jak i opiekę samodzielną. Od czasu wynalazku Clarka z lat 50, którego czujnik stał się kamieniem milowym, początkującym wprowadzenie czujników do praktyk medycznych, można zaobserwować ich znaczący rozwój, czego przykładem są glukometry, które niekiedy nie wymagają nakłucia, a poziom glukozy możliwy jest do monitorowania na ekranie smartfonu. Pomimo kilku dekad rozwoju czujników, ich praktyczne zastosowanie w diagnostyce chorób są jednak wciąż wyzwaniem, czujniki i bioczujniki wymagają znacznych ulepszeń, aby stały się precyzyjnymi narzędziami diagnostycznymi.
Wskaźnikiem stanu zdrowia pacjenta oraz asumptem do postawienia diagnozy, może być obecność i poziom biomarkerów, czyli markerów biologicznych, pełniących rolę sygnatury medycznej dla danego pacjenta. Według słownika opracowanego przez amerykańską Agencję Żywności i Leków (U.S. Food and Drug Administration – FDA) w dokumencie Biomarkers, EndpointS and other Tools (BEST) biomarker sprecyzowany jest jako „zdefiniowana cecha, która jest mierzona jako wskaźnik naturalnych procesów biologicznych, procesów patogennych lub biologicznych odpowiedzi na ekspozycję lub interwencję, w tym interwencje terapeutyczne" [1]. Niejednoznaczna i trudna do sformułowania jest definicja markerów cyfrowych, zasugerowano, że powszechnym błędem jest przekonanie iż są internetowym rozszerzeniem tradycyjnych biomarkerów [2]. W rzeczywistości, pasywnie i cyfrowo zbierane informacje nie muszą być statycznym wzorcem stanu zdrowia ale kombinacją danych pochodzących z czujników, urządzeń monitorujących, zbierających dane liczbowe i obrazy, które obejmują codzienne aktywności osób w różnych warunkach środowiskowych. Na przykład, wyniki pomiarów poziomu cytokiny TGF-β jako biomarkera użytecznego w predykcji raka piersi należy uznać za biomarker tradycyjny, niezależnie od przetwornika zastosowanego do pomiaru i zebrania wyników[3]. Podczas gdy cyfrowa ocena jakości głosu oraz oddechu mieszczą się w kategorii biomarkerów cyfrowych i traktowane są jako wielowymiarowe, czasowo zmienne informacje [4]. Na kliniczną interpretację danych dotyczących markerów biologicznych duży wpływ mają zmienne takie jak płeć, wiek, choroby współistniejące, pochodzenie, styl życia, itp. Dodatkowo, istnieje duże zróżnicowanie w sposobie w jaki laboratoria ustalają wartość graniczną stężeń biomarkerów celu klasyfikacji pacjentów i stadium choroby [5].
Wraz z rozwojem technologii coraz istotniejsze staje się przyjęcie bardziej holistycznego podejścia do gromadzenia i analizy danych. Gwałtowny wzrost popularności smart urządzeń i urządzeń noszonych na ciele (wearables) może ułatwić monitorowanie poziomu biomarkerów, dlatego też koniecznie jest opracowanie zunifikowanych narzędzi, przyjaznych użytkownikowi, który przybliży do wdrożeń klinicznych. Obecnie, bardziej niż kiedykolwiek aktualne staje się pogłębianie wiedzy dotyczącej korelacji między różnymi biomarkerami i ich powiązania z konkretnymi chorobami przy użyciu sztucznego inteligencji i zaawansowanego uczenia maszynowego. Rysunek 1 ilustruje działanie i budowę typowych (bio)czujników, gdzie przetwarzanie danych może być wspomagane przez AI, a integracja danych może być realizowane w ramach Internetu Rzeczy (Internet of Things – IoTs), umożliwiając zbieranie, przetwarzanie i wymianę danych bez ingerencji człowieka. Ponadto, uwzględnienie wielomicznych (metabolomicznych, proteomicznych, genomicznych, transkryptomicznych) sygnatur pacjenta, w sprzężeniu z danymi patologicznymi i kklinicznymi, pomoże w określeniu optymalnego poziomu kluczowych biomarkerów. W konsekwencji powinno to przybliżyć to do wytrenowania przyszłych technologii czujników opartych na AI i/lub zaprojektowania (bio)czujników wielokomponentowych do generowania klinicznie istotnych i spersonalizowanych danych wyjściowych. Dostarczyłoby to informacji wykraczających poza wiedzę ekspertów klinicznych i patologów. Konieczne jest dostarczenie krytycznej perspektywy wykorzystanie AI w rozwoju diagnostyki, z wykorzystaniem podejścia przekrojowego, co pomoże ukierunkować badania nad (bio)sensorami i w perspektywie ich klinicznego przełożenie w najbliższej przyszłości.

3. Wyzwania w medycynie translacyjnej, wprowadzanie nauk biomedycznych do praktyki klinicznej
Medycyna translacyjna zajmuje się przeniesieniem wyników badań naukowych na praktyczne zastosowanie w diagnostyce, leczeniu i profilaktyce chorób. Jej celem jest zwiększenie skuteczności terapii oraz poprawa zdrowia pacjentów poprzez przyspieszenie transferu nowoczesnych technologii medycznych z laboratoriów badawczych do praktyki klinicznej. Europejskie Towarzystwo Medycyny Translacyjnej (European Society for Translational Medicine – EUSTM) wskazało na trzy filary medycyny translacyjnej: (i) naukowcy, (ii) klinicyści oraz (iii) społeczność, tj. fundacje non-profit, uniwersytety, korporacje udostępniające urządzenia/usługi medyczne i leki [6]. Głównym celem ma być testowanie i odkrywanie nowatorskich farmakoterapii, urządzeń i sposobów leczenia. Jednak nasze rozumienie niektórych schorzeń jest ograniczone do specyficznych biomarkerów, co utrudnia kliniczne przełożenie wygenerowanego w laboratorium wyniku. Ponadto, wąskim gardłem jest luka między potrzebną wiedzą/technologiami a odkryciami/wynalazkami, czyli dostosowaniem potrzeb określonych przez klinicystów, rządy i organizacje do prac badawczych podejmowanych przez naukowców w trakcie prac rozwojowych. Wdrożenie wyników badań naukowych do praktyki klinicznej generuje wysokie koszty, brakuje nadzoru regulacyjnego, wsparcia publicznego dla ich udostępniania, a także wiarygodnych danych z otwartych źródeł, przez co bardzo utrudnione jest kliniczne przełożenie badań biomedycznych. Zawiłości związane z kierunkiem badań mającym na celu przenoszenie wiedzy z laboratoriów do praktyki klinicznej, tzw. bench-to-bedside, są przytłaczające. Na przykład, testy diagnostyczne lub inne procedury medyczne, które są wykonywane w jednym miejscu, zazwyczaj w celu zwiększenia wygody lub oszczędności kosztów, ograniczają pozyskiwanie danych prognostycznych tradycyjnych biomarkerów, zwłaszcza od pacjentów w stanie terminalnym, a ich walidacja i wykorzystanie w połączeniu z cyfrowymi wynikami badań biomarkerów jest kosztowne obliczeniowo i trudne do zrealizowania. Należy również podkreślić, że prywatne średnie i małe placówki medyczne zazwyczaj nie widzą uzasadnienia dla kosztów i ryzyka ekonomicznego związanego z przekładem klinicznym, podczas gdy renomowane konglomeraty i instytucje, finansowane przez rząd, zdolne do generowania wyników nadających się do takiego wdrożenia, preferują zamknięty dostęp do takich danych. Dodatkowo, niedostateczna sieć wymiany danych i wiedzy między zaangażowanymi środowiskami, tj. przemysłem, środowiskami akademickimi, lekarzami, pacjentami, agencjami regulacyjnymi i firmami technologicznymi zwiększa złożoność i stopień skomplikowania realnego przeniesienia badań biomedycznych do praktyki klinicznej [7].
Rosnąca popularność aplikacji zdrowotnych opartych na smartfonach i smart urządzeniach stanowi nowe źródło pozyskiwania i zarządzania danymi dotyczącymi cyfrowych biomarkerów. Jednakże brak jasności co do klasyfikacji cyfrowych biomarkerów, różnorodności grup społecznych i ich interakcji z czynnikami środowiskowymi oraz powiązania z tradycyjnymi biomarkerami poważanie ogranicza kliniczne przełożenie urządzeń biomedycznych, które traktowane są jako urządzenia „pseudo-biomedyczne” nie dające gwarancji otrzymania wiarygodnych danych. Istnieje również pilna potrzeba zidentyfikowania różnic pomiędzy tradycyjnymi i cyfrowymi biomarkerami oraz przeprowadzenia systemowej oceny, w jaki sposób mogą być one wykorzystane samodzielnie lub po odpowiednim połączeniu do określenia stanu zdrowia pacjentów. Stopniowo kształtująca się dziedzina cyfrowych biomarkerów zbiega się z tradycyjnymi biomarkerami w zastosowaniach biomedycznych, np. w ocenie wczesnych stadiów choroby Alzheimera [8]. Społeczności kliniczne i badawcze z pewnością odniosłyby korzyści z poświęcenia tym technologiom większej uwagi. Jednak kluczowe jest zrozumienie podstaw ich działania, ograniczeń i możliwości ze stosowania najnowszych bioelektronicznych urządzeń diagnostycznych, wpieranych przez technologię AI/ML jako nowoczesnych narzędzi w diagnostyce klinicznej [9,10].
Bioczujniki zanim zostaną wdrożone do praktyki klinicznej, muszą przejść szereg kompleksowych badań, mających na celu potwierdzenie ich niezawodności, bezpieczeństwa i innych parametrów. Istnieje szereg etapów oceny klinicznej przydatności bioczujników. Jednym z pierwszych etapów jest tzw. etap Proof of Concept, czyli przeprowadzenie wstępnych badań w celu potwierdzenia, że nowa koncepcja ma potencjał w danym zastosowaniu. Umożliwia wstępną ocenę skuteczności i bezpieczeństwa. W tym etapie zwykle przeprowadza się projektowanie i ocenę działania bioczujnika w warunkach laboratoryjnych. Aby upewnić się, że bioczujnik może niezawodnie i precyzyjnie identyfikować pożądane biomarkery, jest on testowany na wybranych próbkach biologicznych. Po tym etapie następują testy przedkliniczne na modelach zwierzęcych. Walidacja kliniczna ocenia przydatność diagnostyczną na wybranej grupie pacjentów w warunkach klinicznych. Aby to ocenić jego działanie stosowane są porównania z technikami stosowanymi rutynowo. Po wykazaniu bezpieczeństwa i skuteczności w badaniach klinicznych ubiegać się można o zatwierdzenie przez organy regulacyjne, zanim bioczujnik będzie mógł być wprowadzony na rynek i skomercjalizowany. Aby zapewnić bezpieczeństwo i skuteczność biosensora w praktyce klinicznej, ocena kliniczna bioczujników jest złożoną i wieloetapową procedurą, która obejmuje współpracę między naukowcami, klinicystami i organami regulacyjnymi. Dostępne bazy danych badań klinicznych przedstawiają obecnie ponad 20 bioczujników w trakcie oceny klinicznych, które działają niezależnie lub w połączeniu z AI/ML w celu śledzenia tradycyjnych i cyfrowych biomarkerów (https://clinicaltrials.gov/) [9].
4. Kryteria stawiane przed czujnikami w medycynie translacyjnej
Zgodnie ze staraniami podjętymi przez Światową Organizację Zdrowia (World Health Organization – WHO) wprowadzono kryteria mające poprawić skuteczność wczesnej diagnostyki chorób, gdzie wyszczególniono przystępność cenową, czułość, specyficzność, przyjazność dla użytkownika, szybkość, solidność i dostępność jako podstawy do oceny testów do diagnozy chorób [11]. Ponieważ nadrzędnym celem w przypadku urządzeń pracujących w trybie PoC, wymagana są również odpowiednio małe rozmiary, możliwość analizy multikomponentowej (ang. multiplex analysis), ponownego wykorzystania i konfiguracji pod kątem ciągłego monitoringu (np. urządzenia noszone na ciele – wereable devices). Tak położone akcenty wpływają na rozwój systemów czujnikowych, które są wydają się najodpowiedniejszymi w tym celu narzędziami, dzięki możliwości pracy PoC, szybkości, specyficzności, czułości, możliwości miniaturyzacji, przystępności cenowej, etc. [12]. Czujniki jako urządzenia analityczne, umożliwiają również wykrycie związków docelowych (ligandów – biomarkerów), poprzez przekształcenie rozpoznania molekularnego w mierzalny, łatwo interpretowalny sygnał analityczny [13]. Zbudowane są z dwóch podstawowych elementów, przetwornika pierwszorzędowego, pełniącego rolę biologicznego elementu receptorowego i przetwornika drugorzędowego, który konwertuje odpowiedź poprzedniego [14]. Rodzaj przetwornika i specyfikacja mogą się różnić w zależności od rodzaju biomarkera i zastosowania końcowego. Na przykład urządzenia do noszenia mogą wymagać bardziej elastycznych, trwałych materiałów, jak również bezprzewodowej transmisji w czasie rzeczywistym z automatycznym przetwarzaniem danych; podczas gdy testy diagnostyczne POC mogą iść na kompromis w odniesieniu do niektórych aspektów, takich jak elastyczność i bezprzewodowa transmisja [15]. By przyspieszyć płynne przejście bioczujników z laboratorium do realnych zastosowań, konieczna jest ocena ich parametrów metrologicznych, takich granica wykrywalności/oznaczalności, trwałość, czułość, specyficzność, itp. Mobilność systemów detekcji jest jednym z głównych czynników utrudniających udane przełożenie kliniczne i komercjalizację. Wyzwaniem jest również moc obliczeniowa i transmisja bezprzewodowa, konieczność odpowiedniego przygotowania próbek lub pacjenta, żywotność urządzenia i odczynników.
Na popularności zyskują urządzenia z własnym zasilaniem, chociaż stabilność i trwałość takich urządzeń nadal pozostaje wyzwaniem. Ostatnie wyniki badań zaowocowały pojawieniem się nanogeneratorów opartych na AI, których celem jest rozwiązanie ograniczeń analizy, projektowania i wytwarzania nanogeneratorów piezoelektrycznych i triboelektrycznych [16]. Przewiduje się, że takie urządzenia oparte na AI/ML miałyby zwiększoną wydajność mechaniczną i elektryczną, co mogłoby pomóc w realizacji samozasilających biosensorów do noszenia. BioScreen jest kolejnym niedawnym przykładem w pełni przenośnego, samozasilającego bioczujnika patogenów działającym w trybie PoC [17]. Koszt (bio)czujnika może się różnić w zależności od kilku czynników, takich jak złożoność urządzenia, materiały użyte do wykonania przetwornika oraz zastosowane elementy (bio)receptorowe. Czynniki te mogą sprawić, że w niektórych przypadkach biosensory będą droższe. Podobnie jak w przypadku wszystkich nowych produktów, biosensory mogą stać się tańsze w miarę rozwoju technologii i wzrostu popytu, dzięki czemu staną się bardziej przystępne i praktyczniejsze w szerszym zakresie zastosowań. W przypadku perspektywy zastosowań klinicznych, walidacja wyników laboratoryjnych w szerszej grupie docelowej, tj. na większe liczbie próbek/pacjentów jest niezbędna do standaryzacji i komercjalizacji.
Przedstawione cechy/parametry metrologiczne są ściśle związane z urządzeniami do detekcji i monitoringu biomarkerów tradycyjnych, jednak ich ocena musi być również wprowadzana w zastosowaniach związanych z markerami cyfrowymi. Postępy w dziedzinie nanotechnologii i elastycznej elektroniki wraz z postępem w technologiach uzupełniających, takich jak mikroprzepływy, bezprzewodowa komunikacja danych, mogą poprawić właściwości przetworników przy jednoczesnym znacznym obniżeniu kosztów. Stanowiące podstawę nowoczesnych bioczujników przetworniki powinny być kompatybilne z elementami biologicznymi i elektronicznymi, a także z niekonwencjonalnymi podłożami, takimi jak skóra czy tekstylia. Oczekuje się również, że będą one monitorować tradycyjne i cyfrowe biomarkery w sposób ciągły i nieinwazyjny, bez obniżania czułości i specyficzności. Ponadto w przyszłości urządzenia do noszenia mogą integrować dwa różne przetworniki do jednoczesnego wykrywania tradycyjnych i cyfrowych biomarkerów. Na przykład tradycyjne biomarkery, które występują w bardzo małych ilościach, mogą wymagać wysoce czułych przetworników, takich jak pojemnościowe lub optyczne, podczas gdy cyfrowe biomarkery, w których wykrywane są markery cyfrowe, tj. akustyczne, wibracyjne lub termiczne, mogą wykorzystywać przetworniki piezoelektryczne lub kalorymetryczne. Współdziałanie takich przetworników pozwoli w przyszłości na wielostronne podejście do konkretnego stanu chorobowego. W porównaniu z konwencjonalnymi testami, mogą stanowić niedrogą i uproszczoną alternatywę dla czasochłonnych analiz laboratoryjnych. Ich pomyślna implementacja jest współzależna od rozwoju biotechnologii, mikro-/nanotechnologii i mikroelektroniki, chemii supramolekularnej, technik obliczeniowych i chemometrycznych, itp., co wpływa na podwyższenie parametrów metrologicznych czujników, przez co mogą one być bardziej użyteczne w praktyce diagnostycznej chorób [18] i nie obciążają środowiska [19]. Aby (bio)czujniki nowej generacji miały zastosowania kliniczne, konieczna jest ocena ich dokładności klinicznej (porównanie z wynikami badań standardowych procedur klinicznych) oraz dokładności analitycznej (porównanie różnic w stosunku do wyników referencyjnych uzyskanych ugruntowanymi technikami).
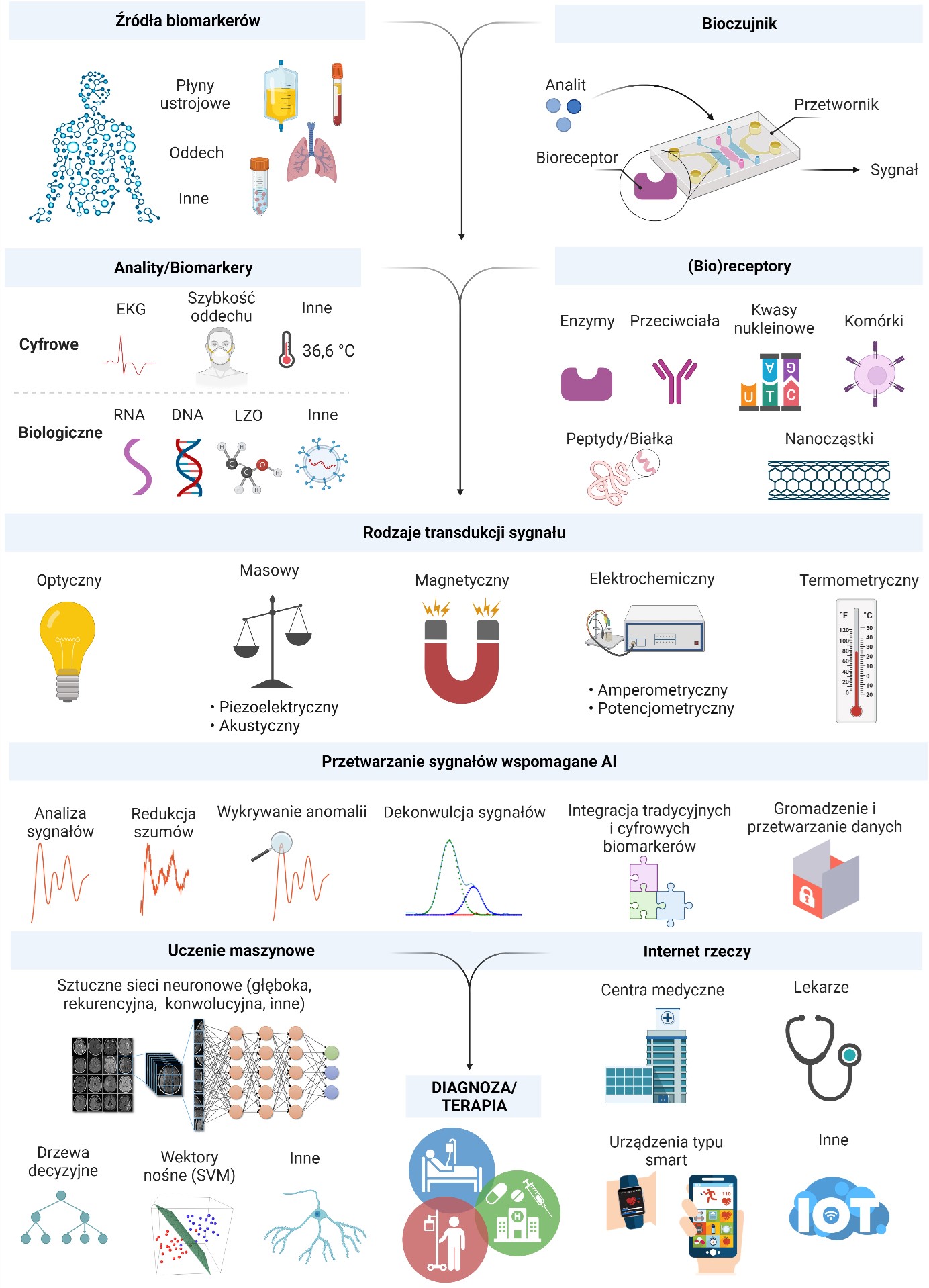 Rysunek 1. Schematyczne przedstawienie komponentów bioczujników do wykrywania tradycyjnych biomarkerów. Uczenie maszynowe i przetwarzanie danych oparte na sztucznej inteligencji umożliwia uwzględnienie i połączenie tradycyjnych biomarkerów z cyfrowymi w celu spersonalizowania opieki zdrowotnej. Uzyskane dane mogą być następnie zbierane, dystrybuowane i oceniane przez centra kliniczne, klinicystów, indywidualnych odbiorców.
Rysunek 1. Schematyczne przedstawienie komponentów bioczujników do wykrywania tradycyjnych biomarkerów. Uczenie maszynowe i przetwarzanie danych oparte na sztucznej inteligencji umożliwia uwzględnienie i połączenie tradycyjnych biomarkerów z cyfrowymi w celu spersonalizowania opieki zdrowotnej. Uzyskane dane mogą być następnie zbierane, dystrybuowane i oceniane przez centra kliniczne, klinicystów, indywidualnych odbiorców.
5. Monitoring i detekcja tradycyjnych biomarkerów
Badania krwi są najczęściej stosowanymi procedurami diagnostycznymi w celu uzyskania wyników poświadczających występowanie określonych chorób, są również pomoce w ocenie stanu zdrowia. Wiąże się to z analizą małej próbki krwi w poszukiwaniu jakichkolwiek zmian lub anomalii w statusie biochemicznym danej osoby, które mogłyby wskazywać na stan patologiczny. Liczne problemy, takie jak infekcje, choroby autoimmunologiczne, nieprawidłowości metaboliczne, dolegliwości wątroby/kardiologiczne i nowotwory złośliwe, mogą być zidentyfikowane dzięki analizie krwi. Mogą być również wykorzystywane do monitorowania postępu choroby, śledzenia skuteczności leczenia i wykrywania potencjalnych problemów zdrowotnych, zanim staną się poważniejsze. Badania krwi są stosunkowo bezbolesne i mogą ujawnić ważne szczegóły dotyczące zdrowia danej osoby. Ważne jest, aby pamiętać, że badania krwi nie zawsze są rozstrzygające i że diagnoza może wymagać powtórzenia badań lub badania w połączeniu z innymi procedurami. Aby uzyskać bardziej szczegółową ocenę stanu pacjenta, często wykonywana są dodatkowe badania, na wyspecjalizowanym sprzęcie, metodami diagnostycznymi i technikami, takimi jak obrazowanie medyczne, analiza chromatograficzna sprzężona ze spektrometrią mas (Gas chromatography-Mass Spectrometry – GC-MS), MRI, RTG i badania genetyczne. Wszystko to wymaga przeszkolonego personelu, który pobiera próbki krwi, a także przeprowadza badania przy wykorzystaniu skomplikowanych procedur oraz często z drogich narzędzi/ testów. Z drugiej strony koncepcja podręcznych (przenośnych) lub noszonych na ciele czujników, które mogą być obsługiwane przez osoby niebędące ekspertami, pozwala na szybsze, a tym samym częstsze przeprowadzanie testów z uzyskiwanie wiarygodnych wyników, które mogą szybko pomóc w określeniu kierunku działania lub leczenia pacjenta. Może to przynieść korzyści w każdej konfiguracji, od pacjentów w domu do tych w izbach przyjęć, gdzie lekarze muszą podejmować szybkie decyzje po pacjentów hospitalizowanych. Konieczność szybkiego i ciągłego monitorowania stanu zdrowia, uświadomiła nam pandemia COVID-19. Posiadanie szybkiego dostępu do wyników badań w momencie pojawienia się objawów zapewnia pacjentowi odpowiedź w ciągu kliku minut, co jest nieocenionym atutem dla zdrowia publicznego m.in. podczas pandemii. W związku z tym rozwój noszonych i podręcznych urządzeń POC do automatycznego monitorowania w czasie rzeczywistym stanu zdrowia użytkownika, momentalnie przyspieszył podczas pandemii. Obecny rynek bioczujników wycenia się na 25,5 mld USD (2021) i przewiduje się, że w 2026 roku osiągnie ok. 40 mld USD [20]. Smart urządzenia elektroniczne (tj. inteligentne zegarki), które mogą wykrywać zmiany sygnałów fizjologicznych, takich jak tętno, tworząc w ten sposób cyfrowe biomarkery i parametry stresu biofizycznego, zyskały szeroką akceptację konsumentów. Niemniej jednak, nie mają one zdolności do wykrywania indywidualnych markerów biochemicznych (np. tradycyjnych), które są związane z konkretnymi stanami chorobowymi; stąd nie sprawdzają się jako testy prognostyczne oparte wyłącznie na danych cyfrowych biomarkerów. Dlatego też podejmowane są wysiłki w celu opracowania platform detekcyjnych, które mogą minimalnie/nieinwazyjnie wykrywać odpowiednie biomarkery w łatwo dostępnych płynach biologicznych, takich jak ślina, płyn śródmiąższowy, pot i mocz, jednocześnie umożliwiając zbieranie cyfrowych sygnatur [21,22]. Reprezentatywne przykłady urządzeń wykorzystywanych do detekcji tradycyjnych biomarkerów przedstawiono na Rysunku 1, gdzie bioczujniki połączone są z:
• Oczami, soczewkami kontaktowymi, [23], okularami [24].
Obecne metody kliniczne wykrywania niektórych wad wzroku, takich jak zaćma, jaskra i zespół czerwonego oka, wymagają zastosowania technik takich jak gonioskopia, pachymetria, perymetria, oftalmoskopia i tonometria, które są stosowane pod nadzorem biegłych okulistów. Techniki te służą do wykrycia aktualnego stanu wady wzroku lub wymagają kompleksowego badania dylatacyjnego oka, aby zdiagnozować je w środkowym lub późnym stadium. Nie nadają się zatem do diagnostyki we wczesnych stadiach choroby. Stąd postępy w nieinwazyjnych pomiarach wykrywania biomarkerów jaskry, umożliwiające diagnozę na wczesnym stadium [25]. Podobnie, zaćma może być wykryta we wczesnym stadium przy użyciu metody wspomaganej smartfonem, wspieranej ML [26]. Ponadto, łzy mogą być wykorzystywane do monitorowania stanu fizjologicznego, jak również czynników prognostycznych w ciężkich stanach chorobowych, takich jak rak czy choroba Alzheimera lub Parkinsona. Do niedawna prace nad czujnikami łez koncentrowały się na monitorowaniu glukozy, obecnie jednak znaczny nacisk przenosi się na nieinwazyjną analizę innych ważnych biomarkerów. Bioczujniki oparte na soczewkach kontaktowych są doskonałą alternatywą dla ciągłego monitorowania składników łez. Soczewki kontaktowe mogą być noszone bez podrażnienia oczu i znajdują się w bezpośrednim sąsiedztwie z łzami. Opracowano m.in. soczewki kontaktowe zintegrowane z papierowymi czujnikami mikroprzepływowymi do analizy łez, które były w stanie wykrywać, jony wodorowe i azotynowe, glukozę oraz kwas L-askorbinowy za pomocą smartfona [23]. Sygnały chromogeniczne z obszaru detekcji były skanowane za pomocą smartfona, a dane były przesyłane do serwerów w chmurze za pomocą bezprzewodowej transmisji.
• Zębami [27], ochraniaczami na zęby [28].
W ostatnich latach ślina jest w dużym stopniu wykorzystywana do badań diagnostycznych jako alternatywa dla badań krwi. Chociaż postępy w dziedzinie elektroniki i mikro-, nanotechnologii przyczyniły się do realizacji zminiaturyzowanych przetworników do szybkiej i czułej diagnostyki to nadal wyzwaniem pozostaje opracowanie wieloanalitowej platformy detekcji o wysokiej specyficzności i czułości. Patrząc na postępy w zakresie łatwych do wykonania, wieloanalitowych i multipleksowych bioczujników, rozwój czujników in vivo i inteligentnych platform zintegrowanych z AI powinien w przyszłości umożliwić opracowanie i/lub dopracowanie takich urządzeń. Obecne standardy kliniczne służące do wykrywania metabolitów śliny, takich jak glukoza, są podobne do systemów monitorowania składników we krwi. Jednakże zawartość glukozy w ślinie może nie odzwierciedlać rzeczywistego poziomu glukozy we krwi, co wymaga oszacowania korelacji pomiędzy poziomem np. glukozy w ślinie i we krwi. Ponadto, niektóre bioczujniki mogą wykrywać specyficzne biomarkery nowotworowe obecne ślinie nimi [29]. Po połączeniu z AI, możliwe jest uzyskanie klinicznie istotnej informacje, w uproszczony sposób niż standardowe techniki przesiewowe, takie jak kolonoskopia i mammografia. W przypadku chorób zakaźnych, bioczujniki stosowane np. na zęby mogą być wykorzystywane do wczesnej diagnostyki chorób zakaźnych, w tym COVID-19, HIV i gruźlicy, poprzez wykrywanie obecności czynników chorób zakaźnych, takich jak wirusy lub bakterie w ślinie, co jest zwykle wykonywane za pomocą metod mikrobiologicznych lub za pomocą testów PCR.
• Pieluchami [30].
Mocz jest kolejnym łatwo dostępnym płynem ustrojowym szeroko wykorzystany do wykrywania biomarkerów takich jak glukoza, kwas moczowy, lotne związki organiczne, czerwone i białe krwinki, bakterie, itp. Analiza moczu to jeden z rutynowych procesów klinicznych, wymaga jednak specjalistów i opiera się na skomplikowanych instrumentach, czasami pobranie moczu bywa również utrudnione. Do rutynowej analizy zawartości cukrów w moczu powszechnie stosuje się testy paskowe do wykrywania m.in. poziomu glukozy i ketonów u pacjentów z cukrzycą. Jednak w porównaniu z analizą metabolitów, szybkie wykrywanie zakażeń dróg moczowych jest dużym problemem, gdzie klasyczne techniki wymagają kilku dni, aby zidentyfikować bakterie i poziom ich wrażliwości na antybiotyki. Pomimo intensywnych badań, głównym wyzwaniem dla rozwoju bioczujników zakażeń układu moczowego jest występowanie wielu uropatogenów i rosnąca antybiotykooporność bakterii. Niedawno opracowano system bioczujnikowe, które łączą pieluchę z aplikacją w smartfonie i wykrywają in situ ilości oddawanego moczu, przypominając o terminowej wymianie pieluch i mierzą poziomy biomarkerów w czasie rzeczywistym takich jak glukoza i kwas moczowy [30]. Ponadto, z pomocą AI, w połączeniu z algorytmami ML, takie bioczujniki mogą wykazać się lepszą wydajnością wykrywania i przetwarzania danych [31]. Istotne klinicznie dane mogą zostać wyodrębnione i przeanalizowane przy użyciu dwóch algorytmów, lasu losowego (Random Forest – RF) i sieci neuronowej (Neural Network – NN). Wysoce czuły system w połączeniu z ML wykazał wysoką precyzję w badaniach przesiewowych raka prostaty przy użyciu tylko jednej kropli moczu.
• Opaskami na ręce, głowę [32], bezpośrednio na skórę [33–36], ubraniami [37,38].Umożliwiają detekcję cyfrowych i tradycyjnych biomarkerów. W praktyce klinicznej stosuje się elektrody aktywności fizjologicznej, EEG, EKG, EMG, itd. Ogromne znacznie mogą mieć bioczujniki na skórę szczególnie do detekcji metabolitów obecnych w płynach biologicznych, np. pocie. Problemy związane z ich stosowaniem wynikają z niewystarczającego przytwierdzenia do skóry, podrażnień skóry, braku komfortu, problemami z kalibracją, różnic w grubości skóry, jej wilgotności i innych czynników. Możliwe jest bezpośrednie zastosowanie czujników na skórę z wykorzystaniem drukowanych tymczasowych tatuaży lub e-skóry lub też pośrednio poprzez plastry/opaski lub osadzenie w tekstyliach o podwyższonej zdolności mechanicznej podczas ruchu [39]. Niektóre zastosowania wymagają ciągłego monitorowania składników potu, gdzie ilość potu może nie zaspokajać zapotrzebowania. Ponadto wpływ ma stopień rozcieńczenia analitu podczas pocenia. Dlatego głębsze zrozumienie chemii i transportu potu, a następnie potrzeba inteligentnego monitorowania i przewidywania są wymagane, aby przyspieszyć możliwości diagnostyczne oparte na tym płynie. Rozwiązaniami mogą być technologie mikropompy zintegrowane z receptorami, mogące regulować przepływ potu. Nowszym podejściem jest integracja AI/ML w celu zwiększenia wydajności bioczujników na skórę [40].
• Maseczkami [41,42].
Analizą zawartości lotnych związków organicznych (LZO) w oddechu w celu diagnozowania różnych chorób i stanów zdrowotnych pochodzących ze specyficznego metabolizmu komórkowego, tkankowego oraz lokalnego mikrobiomu jest dziedziną bardzo szybko zyskującą na popularności i prace rozwojowe w tej tematyce (ogólnie nazywanej w nomenklaturze angielskiej „breathomics”) znacznie przyspieszyły w ostatnich latach. Złotym standardem w zakresie analitycznego podejścia do wykrywania lotnych biomarkerów wciąż jest kombinacja chromatografii gazowej ze spektrometrią mas. Ze względu na niektóre niedogodności związane z klasycznymi technikami analizy lotnych biomarkerów, tj. przeszkoleniem personelu, kosztami przygotowania próbek, analizy i sprzętu; obecny trend ukierunkowany jest na rozwój bioczujników jako nieinwazyjnych i szybkich narzędzi diagnostycznych.. W ostatnich latach, diagnostyka chorób ukierunkowana jest na szybkie, proste i nieinwazyjne metody, oparte m.in. na wykrywaniu lotnych związków organicznych (LZO) i charakterystycznych profili LZO jako markerów diagnostycznych, które powstają w wyniku procesów chorobowych zmieniających normalne szlaki fizjologiczne i metaboliczne. Ciągle rośnie zainteresowanie metodami analizy powietrza wydychanego, które jest mieszaniną wieloskładnikową, zawierającą liczne substancje lotne, np. aldehydy, ketony, tlenki azotu, tlenki siarki i inne. Skuteczne wykrycie na wczesnym etapie markerów chorobowych może skutkować wczesną diagnozą początkowego stanu chorobowego i skierowaniem pacjenta do dalszych badań w celu wykluczenia bądź potwierdzenia jednostki chorobowej. Ponadto, analiza oddechu może być również przydatna do monitorowania zapalenia dróg oddechowych i doboru odpowiedniego leczenia farmakologicznego. Niska dostępność nieinwazyjnych metod monitorowania i identyfikacji m.in. stanu zapalenia dróg oddechowych skłania ku rozwojowi technik umożliwiających analizę oddechu pod kątem określenia profili zapachowych, tzw. „odcisków palca”, np. z wykorzystaniem elektronicznych i bioelektronicznych nosów [43]. Jest to prężnie rozwijająca się dziedzina, która ma potencjalny wpływ kliniczny i może dać możliwości wczesnego wykrywania i oceny przebiegu m.in. astmy, obturacyjnej choroby płuc, raka płuc, śródmiąższowej choroby płuc, chorób ogólnoustrojowych, wirusowych, itp.. Przyspieszenie diagnozy, m.in. raka płuc jest wysoce pożądane, gdyż konwencjonalne metody, jak radiografia klatki piersiowej, cytologia plwociny, biopsja, czy tomografia komputerowa, uniemożliwiają przeprowadzanie szybkich badań przesiewowych szerokiego zakresu populacji. Najczęściej diagnozowane są stadia, gdzie leczenie jest już utrudnione i nieskuteczne ze względu na zbyt późną diagnozę. Dlatego zapotrzebowanie na skuteczne i szybkie narzędzia do wczesnego wykrywania jednostek chorobowych poprzez nieinwazyjną analizę oddechu pacjentów jest zarówno krytyczne, jak i pilne. Pomyślna implementacja jest zależna od rozwoju biotechnologii, mikro-/nanotechnologii, elektroniki, chemii supramolekularnej, technik obliczeniowych, co wpływa na podwyższenie parametrów metrologicznych bioczujników, przez co mogą one być bardziej użyteczne w diagnostyce chorób. Korelacja między zmiennością składników oddechu a stanem zdrowia może być monitorowana w sposób ciągły, co byłoby szczególnie przydatne w czasie epidemii, gdzie oddech jest nośnikiem infekcji. Maseczki z zamontowanymi bioczujnikami z elementem porfirynami jako elementami receptorowymi zostały zaproponowane przez zespół Di Natale i były w stanie wykrywać niektóre LZO na tle normalnego oddechu [44]. Równoległym kierunkiem badań w zakresie rozwoju bioczujników jest opracowanie metod modelowania molekularnego do opracowania bibliotek elementów receptorowych zdolnych do detekcji wybranych ligandów, które mogą być zakwalifikowane do lotnych biomarkerów [45] i posłużyć do konstrukcji testów PoC. Główną zaletą opracowania takich biosensorów jest ich nieinwazyjne pobieranie próbek i monitorowanie w czasie rzeczywistym, co czyni je idealnymi z klinicznego punktu widzenia. Wybrane grupy firm spin-off z branży przemysłowo-akademickiej, w tym Rapid Biosensor Systems Ltd. (rapidbiosensor.com) i Owlstone (owlstonemedical.com) tworzą urządzenia na wzór alkomatów, które umożliwiają wstępną diagnozę gruźlicy i szeregu innych chorób układu oddechowego.
• Smartfonami [30,46,47].
Rosnąca popularność aplikacji zdrowotnych dostępnych na smartfony oraz urządzeń peryferyjnych takich jak smart-zegarki, smart-pierścionki, itp. zapewniają nowe sposoby pozyskiwania i zarządzania danymi z biomarkerów cyfrowych. Jednak brak przejrzystości, co do ich klasyfikacji, różnorodność grup społecznych i interakcji z czynnikami środowiskowymi oraz tradycyjnymi biomarkerami istotnie wpływa na kliniczne przełożenie tego typu urządzeń biomedycznych. W stopniowo kształtującej się dziedzinie, skupiająca się na pozyskiwaniu, analizie i przechowywaniu cyfrowych biomarkerów za pomocą smartfonów, kluczowe jest zrozumienie sposobu jej funkcjonowania i możliwości. Przykładowo, właściwości optoelektroniczne nanomateriałów i nanokompozytów mogą być wykorzystane do wspomaganej smartfonem detekcji kolorymetrycznej biomarkerów [48], nowatorska procedura obejmowała nieenzymatyczną strategię wykrywania glukozy przy mocy nanocząstek złota przy pomocy czujnika na bazie powierzchniowego rezonansu plazmonowego (SPR – Surface Plasmon Resonance). Technika została z powodzeniem zastosowana do ilościowego oznaczania glukozy w próbkach moczu. Podobne rozwiązania na bazie nanocząsteczek i przetwarzania danych w smartfonie są stosowane do analizy śliny [49], dodatkowo czujnik spełnił założenia testów PoC, przez co jest obiecującą platformą do zastosowań biomedycznych w praktyce klinicznej. Mikro- i nanokompozyty o właściwościach enzymów, ze względu na wysoką specyficzność i selektywność wiązania, mają ogromny potencjał w testach PoC również w połączeniu z urządzeniami noszonymi na skórze, tj. wearables. W połączeniu z odpowiednimi narzędziami AL/ML mogą być z powodzeniem stosowane w testach PoC, co zostało szczegółowo opisane w pracy przeglądowej Jeon et al. [50].
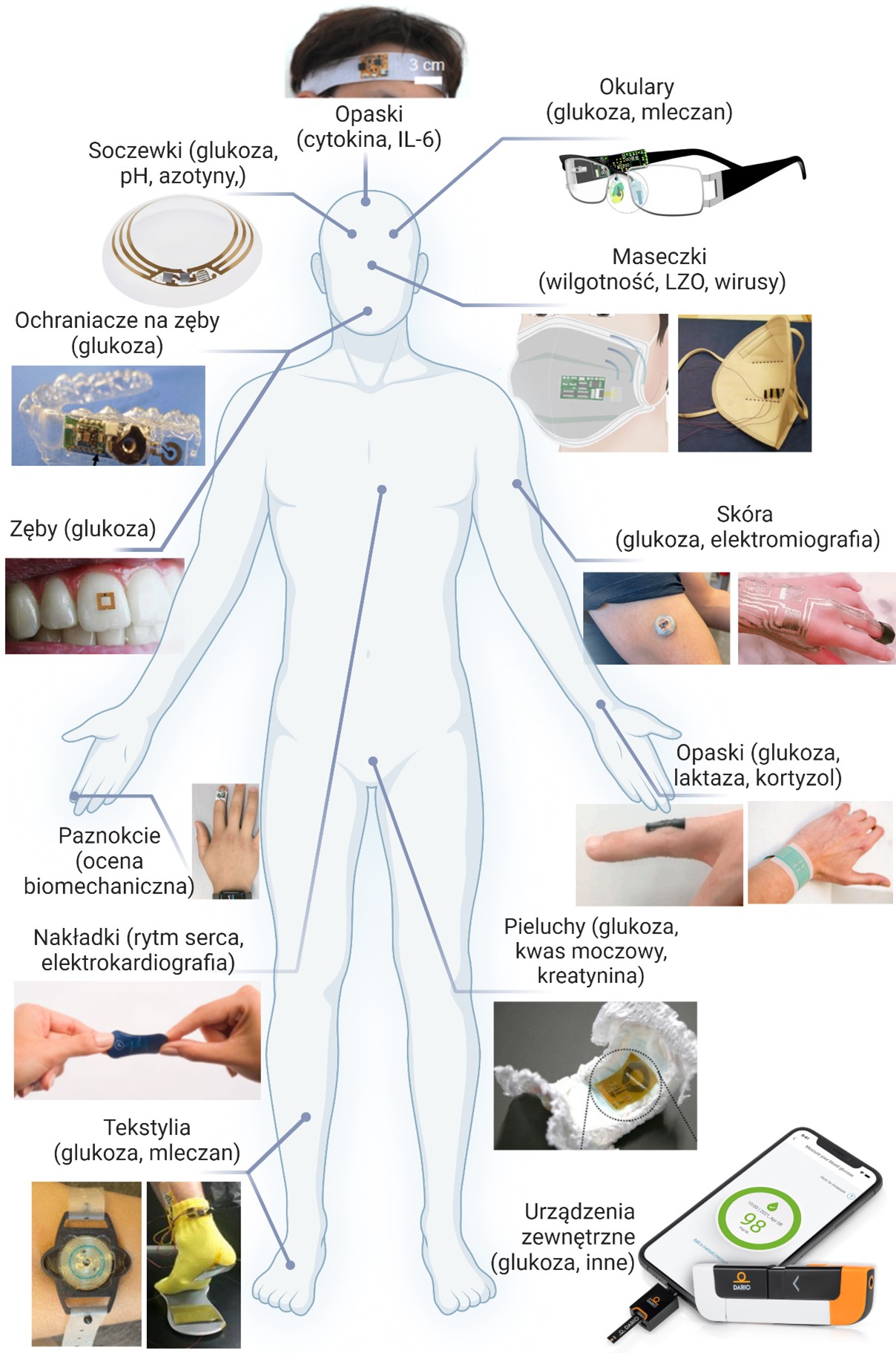 Rysunek 2. Przykłady urządzeń do detekcji/monitoringu biomarkerów tradycyjnych.
Rysunek 2. Przykłady urządzeń do detekcji/monitoringu biomarkerów tradycyjnych.
6. Diagnoza wspomagana metodami sztucznej inteligencji
Badania multiomiczne, ze względu na na precyzyjne i dokładne dla danej osoby lub większej próby wyniki, są obecnie na fali wznoszącej wśród naukowców i klinicystów. Przewaga technologi multiomicznych w genomice, transkryptomice, epigenomice, proteomice, metabolomice i innych obszarach jest uznawana za kluczową w rozwoju spersonalizowanych leków w celu dostosowania opieki zdrowotnej do pacjenta [51]. Na przykład podejmowane są wysiłki w celu wygenerowania kompleksowych profili multiomicznych dla 20 000 podmiotów i wygenerowania dodatkowych danych w nadchodzących latach dla różnych typów nowotworów (The Cancer Genome Atlas-TCGA, https://portal.gdc.cancer.gov/). Jednak w porównaniu do konwencjonalnej analizy wieloomowej, która generuje dużą ilość danych w pojedynczym eksperymencie, który nie jest przeprowadzany w czasie rzeczywistym, bioczujniki oparte na podejściach wieloomowych mogą stać się obiecującymi platformami do monitorowania w czasie rzeczywistym z jednoczesnym obniżeniem kosztów. Jednoczesne monitorowanie wielu biomarkerów poprzez multipleksowanie bioczujników, czyli jednoczesną analizę kilku markerów, może prowadzić do wczesnego wykrywania, zapobiegania i leczenia chorób w czasie rzeczywistym [52]. W tym sensie badania nad wszechstronnymi czujnikami bioelektronicznymi/elektrochemicznymi do jednoczesnego wykrywania i ciągłego monitorowania różnych biomarkerów przy użyciu prostych, niedrogich i szybko reagujących elementów mogą prowadzić do spersonalizowanej diagnozy i płynnego przełożenia klinicznego. Jednak analiza danych generowanych przez wiele systemów wymaga zaawansowanego podejścia obliczeniowego, począwszy od integracji danych, statystyk i systemów AI/ML, aby stała się użyteczna dla pacjentów i lekarzy. Naukowcy wskazują obecnie na multipleksowanie biosensorów elektrochemicznych, których skuteczność można znacznie zwiększyć po zintegrowaniu z dobrze wyszkoloną sztuczną inteligencją lub/oraz uczeniem maszynowym w celu uzyskania klinicznie istotnych wyników. AI/ML może być wykorzystywana zarówno do sortowania i przewidywania wyników z bioczujników, jak i do zwiększania ich czułości. Dlatego istotne jest zrozumienie i rozwijanie AI/ML, aby w pełni wykorzystać potencjał bioczujników w perspektywie klinicznej.
Chociaż integracja sztucznej inteligencji z bioczujnikami wymaga jeszcze wielu działań i udoskonaleń, inteligentne przetwarzanie danych może zrewolucjonizować dziedzinę bioczujników. W ciągu ostatnich kilku lat czujniki do noszenia wspierane przez sztuczną inteligencję pojawiły się jako niedrogie rozwiązanie do monitorowania stanu zdrowia użytkowników. Sztuczna inteligencja pracuje nad eksploracją dostępnych danych, w celu znalezienia anomalii cyfrowych, sortowania danych, redukcji szumów, integracji rynków bio-cyfrowych i wyciągania wniosków do interpretacji istotnych klinicznie. Aby osiągnąć taką dokładność, sztuczna inteligencja odgrywa dwie istotne role. Pierwszą z nich jest skupienie się na redukcji niepożądanych informacji przed transmisją danych, co jednocześnie zmniejsza zużycie energii potrzebnej do transmisji bezprzewodowej. Drugą jest położenie nacisku na kwestie jakości danych, takie jak dokładność, powtarzalność i stabilność. Aspekty te są ważne dla zbadania współzależności biomarkerów w złożonych próbkach biologicznych, a także w tradycyjnych i cyfrowych markerach, oferując perspektywy rozwiązania pilnych wyzwań w dziedzinie bioczujników, takich jak dokładność, niezawodność szybkość i czas życia. Przykładowo, metoda obrazowania optycznego Ramana w połączeniu z głębokimi konwolucyjnymi sieciami neuronowymi (CNN) została opracowana w celu automatycznego przewidywania guza mózgu w czasie rzeczywistym [53]. Przewidywanie oparte na CNN wykazało 94,6% dokładność, która była wyższa od interpretacji konwencjonalnych obrazów histologicznych przez patologów, tj. 93,9%. Podobnie jak CNN, sztuczna sieć neuronowa (artificial neural network - ANN), rekurencyjna sieć neuronowa (recurrent neural network - RNN), maszyna wektorów nośnych (support vector machine - SVM), analiza głównych głównych (principal component analysis - PCA), hierarchiczna analiza skupień (hierarchical clustering analysis - HCA), drzewo decyzyjne (decision tree - DT), analiza dyskryminacyjna lub regresja najmniejszych kwadratów (partial least squares discriminant analysis – PLSDA), (partial least squares regression - PLSR) są dostępne i przyjęte do zastosowań bioczujnikowych.
Rysunek 2 przedstawia podstawowe koncepcje uczenia maszynowego. Przykładowo, ML może być realizowane w sposób nadzorowany lub nienadzorowany. Algorytm nadzorowanym, został m.in. wykorzystany do dokładnego przewidywania poziomu glukozy we krwi przy użyciu lotnych związków organicznych w oddechu [54]. Oprócz analizy poziomu glukozy we krwi, SVM są szeroko wykorzystywane do diagnozowania raka i wykrywania patogenów przenoszonych przez wodę. SVM zastosowana w przypadku raka piersi zwiększyła dokładność diagnozy o 33,34% i zmniejszyła wariancję diagnozy o 97,89% [55]. Nienadzorowane algorytmy ML są wykorzystywane do analizy i grupowania nieoznakowanych zbiorów danych [56]. Algorytmy te mogą odkrywać ukryte wzorce w danych bez konieczności interwencji człowieka. PCA jest przykładem nienadzorowanego algorytmu ML używanego do osiągnięcia redukcji wymiarowości poprzez zastąpienie zestawu zmiennych głównymi składowymi i szeroko stosowana w systemach czujnikowych i bioczujnikowych [57,58]. Dostępna jest obszerna literatura na temat bioczujników obsługujących AI/ML [59,60], gdzie przedstawiane są badania pilotażowe wymagające oceny klinicznej. Na przykład, intensywnie rozwijane są badania wykorzystujące dane kliniczne pacjenta do optymalizacji i kontroli algorytmu pomiarowego bioczujników, noszonych na skórze do kontroli glukozy. Wyniki diagnostyczne wyszkolonego algorytmu są porównywane z pomiarami stężenia glukozy we krwi metodą referencyjną oraz równoległymi pomiarami częstości akcji serca i SpO2. Mimo to, algorytmy te mają pewne ograniczenia, zwłaszcza w przypadku algorytmów predykcyjnych, które są generalnie zaprojektowane w celu poprawy dokładności urządzeń, ale w dużej mierze opierają się na kalibracji przy użyciu złotych standardów. Niemniej jednak, ponieważ technologie te osiągają akceptowalny stopień dokładności przy użyciu dobrze dostosowanych algorytmów, ich przydatność jako narzędzi diagnostycznych na pewno w najbliższej przyszłości znacznie ostatecznie wzrośnie, co pokazuje wzrost badań w tej tematyce [61].
7. Perspektywy rozwoju i podsumowaniePomimo rosnącej liczby zastosowań technologii opartych na sztucznej inteligencji, niewiele z nich znalazło na dzień dzisiejszy realne zastosowania w trybie PoC. Jako „wąskie gardła” wskazuje się głównie konieczność walidacji urządzeń, wymiany danych, ich prywatności oraz logistyki związanej z wdrażaniem [62]. Aplikacje typu i-PROGNOSIS, oparte na smartfonach są przykładami projektów, CovidSense, które zajmują się analizą różnego typu markerów zbieranych głównie za pomocą smartfona i respektują politykę prywatności oraz bezpieczeństwa danych są w stanie przebić znaleźć realne zastosowania z korzyścią dla szerokiego grona pacjentów. Przy użyciu czujników opartych na smartfonach możliwe jest wykrywanie chorób, co zostało opisane w projekcie Europejskim iPROPELIS (nr 101095697). Dzięki zastosowaniu aplikacji, możliwe jest wykrycie zmian strukturalnych w płytce paznokcia, świadczące o występowaniu łuszczycy bądź łuszczycowym zapaleniu stawów (https://cordis.europa.eu/project/id/101095697). W oparciu o inteligentne urządzenia i m.in czujniki do noszenia można opracować nowe cyfrowe biomarkery, zgodnie z najlepszymi praktykami, w celu stworzenia, obok istniejących rozwiązań, systemu do obiektywnego śledzenia markerów i oceny ryzyka, prognozowania, diagnozowania bądź rozwoju choroby. Prognozuje się, że w przyszłości skuteczne modele sztucznej inteligencji będą wymagały nowatorskich interfejsów człowiek-AI/maszyna, umożliwiające zbieranie i przetwarzanie markerów w czasie rzeczywistym, dając informacje o stanie zdrowia pacjenta. Istnieje jednak pilna potrzeba jednoczesnej oceny tradycyjnych oraz cyfrowych biomarkerów w czasie rzeczywistym przy użyciu sztucznej inteligencji, aby zrealizować cele medycyny spersonalizowanej. Połączeniem tych strategii jest stosowanie czujników, które są w stanie monitorować biomarkery cyfrowe (ciśnienie krwi, tętno) oraz poziom biomarkerów tradycyjnych (glukoza, mleczan, kofeina i inne). Przetworniki ultradźwiękowe monitorują cyfrowe biomarkery, a czujniki elektrochemiczne mierzyły poziomy tradycyjnych biomarkerów. Zaprojektowany czujnik [63] do noszenia na skórze składał się ze sztywnych i miękkich elementów, tj. niestandardowych piezoelektrycznych przetworników ultradźwiękowych z cyrkonianu ołowiu, przetworników ultradźwiękowych z tytanianu ołowiu i drukowanych kompozyty polimerowych, odpowiednio o wysokiej odporności mechanicznej i odporności na korozję. To urządzenie jest pierwszym krokiem w kierunku multimodalnych czujników do noszenia, jako połączone czujniki akustyczne i elektrochemiczne do bardziej kompleksowego monitorowania stanu zdrowia człowieka. Autorzy sugerują, że przyszły rozwój samodzielnego interfejsu zintegrowanego z AI/ML, w pełni przekształciłby obecne urządzenie w inteligentny system noszony na skórze.
Tabela 1. Zalety i ograniczenia związane z wykrywaniem biomarkerów cyfrowych i tradycyjnych z wykorzystaniem AI.

Postęp w dziedzinie bioelektroniki, urządzeń „ubieralnych”, urządzeń konsumenckich i cyfryzacji umożliwił monitorowanie danych zdrowotnych w czasie rzeczywistym i poza konwencjonalnymi warunkami klinicznymi. Rosnące zaufanie do smart-urządzeń zwiększa zapotrzebowanie tych technologii przez konsumentów, badaczy i dostawców usług. Możliwość ciągłego gromadzenia danych zdrowotnych z naturalnego środowiska użytkownika, która kiedyś była ograniczona do warunków klinicznych, ma zrewolucjonizować i zdecentralizować opiekę zdrowotną. Jednakże, ciągłe monitorowanie może prowadzić do przeszacowania stanu zdrowia danej osoby, powodując sytuacje paniki. Ponadto zmienność danych wyjściowych czujnika, tj. stosunek sygnału do szumu i wynikająca z tego dokładność, zwłaszcza w przypadku danych pojedynczego analitu, może prowadzić do fałszywych wyników, ponieważ wiele czynników może wpływać na stężenie pojedynczego biomarkera. Ponieważ wiele analitów może być powiązanych z określonym stanem fizjologicznym, analiza multipleksowa wraz z integracją cyfrowych biomarkerów z surowymi danymi powinna generować bardziej całościowy obraz stanu zdrowia pacjenta. Ten rodzaj pełnowartościowego wykrywania generuje bardzo istotne dane kliniczne, które w znacznym stopniu wymagają interwencji AI/ML w celu sortowania i przewidywania wyników. Niezbędne jest zatem zintegrowanie różnorodnych technologii, które pozwolą na gromadzenie szerokiego zakresu danych przy jednoczesnej maksymalizacji dokładności informacji. Kluczowym elementem byłoby połączenie tradycyjnych danych z cyfrowymi biomarkerami i zintegrowanie ich z dobrze wyszkoloną sztuczną inteligencją przy użyciu danych wielomicznych. Umożliwiłoby to wdrożenie swoistej oceny krzyżowej i łączenie spersonalizowanych biomarkerów, co ma kluczowe znaczenie dla zapewnienia jasnego wskazania stanu zdrowia i zminimalizowania niepotrzebnych czynników wywołujących lęk. Istnieje zatem pilna i często zaniedbywana potrzeba walidacji powiązania tradycyjnych biomarkerów z markerami cyfrowymi i odwrotnie. Technologie zintegrowane ze sztuczną inteligencją z możliwością multipleksowania z pewnością byłyby bardziej zgodne z mechanizmem regulacyjnym i łatwo przechodziłyby przez wąskie gardła kliniczne, handlowe i konsumenckie. Nie umniejszając w żaden sposób obecnym badaniom i postępom w zakresie bioczujników i AI/ML, należy zadać sobie pytanie, jaki poziom dokładności klinicznej i analitycznej powinny one osiągnąć, zanim zostaną uznane za "wystarczająco dobre" do wdrożenia do praktyki klinicznej. Przyszłość bioczujników jest obiecująca, a ciągły postęp technologiczny prowadzi do dokładniejszych i tańszych czujników. Na przykład zdolność pacjentów do śledzenia poziomu glukozy we krwi w czasie rzeczywistym już zmieniła praktyki, którymi kierują się pacjenci chorzy na cukrzycę.
Markery cyfrowe mogą być wykorzystywane do znajdowania wzorców i prognozowania wyników zdrowotnych dzięki rozwojowi AI. Przyszły rozwój sugeruje, że platformy cyfrowego zdrowia będą w coraz większym stopniu włączać bioczujniki do swoich systemów. Pacjenci będą mogli udostępniać swoje dane pracownikom służby zdrowia i monitorować swoje zdrowie w czasie rzeczywistym, co doprowadzi do bardziej zindywidualizowanej i profilaktycznej opieki zdrowotnej. W tej cyfrowej ścieżce klinicznej należy wziąć pod uwagę konieczność zacieśniania współpracy międzydyscyplinarnej, gdzie sztuczna inteligencja może odegrać ważną rolę w procesie łączenia różnych światów nauki.
Na koniec nie mogło zabraknąć nawiązania do modelu językowego opartego na sztucznej inteligencji, opracowanego przez OpenAI, który w 2023 roku był tematem wielu debat i sporów. Okazuje się, że za jego pomocą można w łatwy sposób nakierować się na poprawną interpretację wyników badań laboratoryjnych. W publikacji The AI Revolution in Medicine. GPT-4 and Beyond, przetestowano ten model językowy w zakresie m.in. poprawności diagnozowania. Stwierdzono, że ChatGPT może wskazać diagnozę i zaplanować leczenie ale popełniane błędy przy obliczaniu np. czasu przepływu wlewu żylnego dyskwalifikują go jako pełnoprawnego „lekarza online”. Subtelne błędy mogą prowadzić do poważnych konsekwencji, z drugiej strony również lekarze z „prawdziwego zdarzenia” nie są wolni od pomyłek ale w ich przypadku istnieją uregulowania prawne, które mają za zadanie wymuszać na lekarza środki ostrożności i dbanie o dobro pacjenta. Podobnie jak w przypadku mobilnych aplikacji zdrowotnych, trzeba rozgraniczać zastosowania modeli językowych do tych obarczonym wysokim i niskim ryzykiem, gdzie np. stawianie mających bezpośredni wpływ na zdrowie i życie pacjentów – wymaga nadzoru, konieczna jest obecnie ocena wykwalifikowanych specjalistów.
Na koniec, przekornie zapytajmy samej sztucznej inteligencji, czyli chatu GPT, czy zastąpi w przyszłości lekarzy, odpowiedzi przedstawiono poniżej. Co ciekawe, początkowe wersje chatu wskazywały już w pierwszym zdaniu, że sztuczna inteligencja nie zastąpi lekarzy, natomiast kolejnym brakowało takiej jednoznaczności.
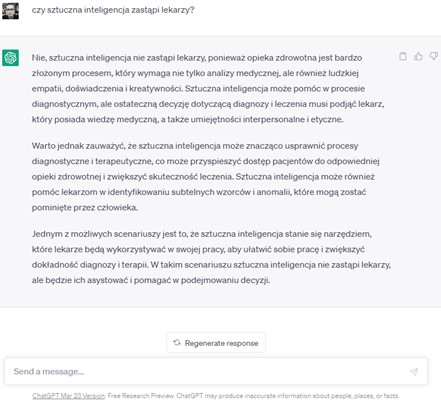
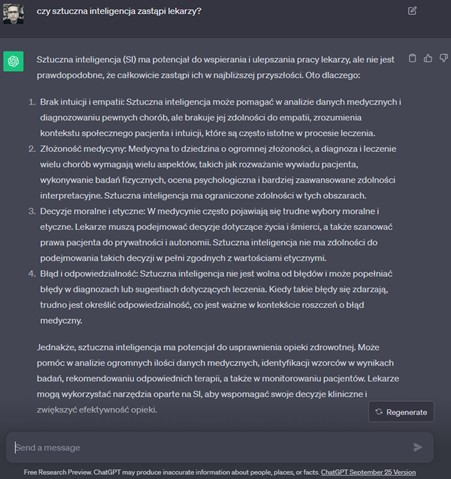 Rysunek 3. Odpowiedzi dwóch wersji chatuGPT na pytanie dotyczące przyszłości sztucznej inteligencji w medycynie.
Rysunek 3. Odpowiedzi dwóch wersji chatuGPT na pytanie dotyczące przyszłości sztucznej inteligencji w medycynie.
8. Literatura
2. Au, R.; Kolachalama, V. B.; Paschalidis, I. C. Redefining and Validating Digital Biomarkers as Fluid, Dynamic Multi-Dimensional Digital Signal Patterns. Front. Digit. Heal. 2022, 3, doi:10.3389/fdgth.2021.751629.
3. de Miguel-Perez, D.; Russo, A.; Gunasekaran, M.; Buemi, F.; Hester, L.; Fan, X.; Carter-Cooper, B. A.; Lapidus, R. G.; Peleg, A.; Arroyo-Hernández, M.; Cardona, A. F.; Naing, A.; Hirsch, F. R.; Mack, P. C.; Kaushal, S.; Serrano, M. J.; Adamo, V.; Arrieta, O.; Rolfo, C. Baseline extracellular vesicle TGF-β is a predictive biomarker for response to immune checkpoint inhibitors and survival in non–small cell lung cancer. Cancer 2023, 129, 521–530, doi:10.1002/cncr.34576.
4. Robin, J.; Harrison, J. E.; Kaufman, L. D.; Rudzicz, F.; Simpson, W.; Yancheva, M. Evaluation of Speech-Based Digital Biomarkers: Review and Recommendations. Digit. Biomarkers 2020, 4, 99–108.
5. Yang, J.; Tu, X.; Zhao, H.; Lin, X.; Xie, Y.; Li, S.; Wang, M. A Comparative Study of Levels of Serum Biomarkers in Patients with Different Stages of Asthma. Chinese Gen. Pract. 2022, 25, 1700–1706, doi:10.12114/j.issn.1007-9572.2022.0031.
6. Carhart-Harris, R. L. Translational Challenges in Psychedelic Medicine. N. Engl. J. Med. 2023, 388, 476–477, doi:10.1056/nejmcibr2213109.
7. Babrak, L. M.; Menetski, J.; Rebhan, M.; Nisato, G.; Zinggeler, M.; Brasier, N.; Baerenfaller, K.; Brenzikofer, T.; Baltzer, L.; Vogler, C.; Gschwind, L.; Schneider, C.; Streiff, F.; Groenen, P. M. A.; Miho, E. Traditional and Digital Biomarkers: Two Worlds Apart? Digit. Biomarkers 2019, 3, 92–102, doi:10.1159/000502000.
8. Piau, A.; Wild, K.; Mattek, N.; Kaye, J. Current state of digital biomarker technologies for real-life, home-based monitoring of cognitive function for mild cognitive impairment to mild Alzheimer disease and implications for clinical care: Systematic review. J. Med. Internet Res. 2019, 21.
9. van Dam, J.; Wright, J.; Jones, G. The Convergence of Digital Health Technologies: The Role of Digital Therapeutics in the Future Healthcare System. In Digital Therapeutics: Strategic, Scientific, Developmental, and Regulatory Aspects; 2022; pp. 351–372 ISBN 9781000799231.
10. Arya, S. S.; Dias, S. B.; Jelinek, H. F.; Hadjileontiadis, L. J.; Pappa, A.-M. The convergence of traditional and digital biomarkers through AI-assisted biosensing: A new era in translational diagnostics? Biosens. Bioelectron. 2023, 115387, doi:10.1016/j.bios.2023.115387.
11. Kosack, C. S.; Page, A. L.; Klatser, P. R. A guide to aid the selection of diagnostic tests. Bull. World Health Organ. 2017, 95, 639–645, doi:10.2471/BLT.16.187468.
12. Baryeh, K.; Takalkar, S.; Lund, M.; Liu, G. Introduction to medical biosensors for point of care applications. In Medical Biosensors for Point of Care (POC) Applications; 2017; pp. 3–25 ISBN 9780081000786.
13. Polizzi, K. M. Biosensors. In Comprehensive Biotechnology; 2019; pp. 572–584 ISBN 9780444640475.
14. Wasilewski, T.; Gębicki, J.; Kamysz, W. Advances in olfaction-inspired biomaterials applied to bioelectronic noses. Sensors Actuators B Chem. 2018, 257, 511–537, doi:10.1016/j.snb.2017.10.086.
15. Sempionatto, J. R.; Mishra, R. K.; Martín, A.; Tang, G.; Nakagawa, T.; Lu, X.; Campbell, A. S.; Lyu, K. M.; Wang, J. Wearable Ring-Based Sensing Platform for Detecting Chemical Threats. ACS Sensors 2017, 2, 1531–1538, doi:10.1021/acssensors.7b00603.
16. Askari, H.; Xu, N.; Groenner Barbosa, B. H.; Huang, Y.; Chen, L.; Khajepour, A.; Chen, H.; Wang, Z. L. Intelligent systems using triboelectric, piezoelectric, and pyroelectric nanogenerators. Mater. Today 2022, 52, 188–206.
17. Macchia, E.; Kovács-Vajna, Z. M.; Loconsole, D.; Sarcina, L.; Redolfi, M.; Chironna, M.; Torricelli, F.; Torsi, L. A handheld intelligent single-molecule binary bioelectronic system for fast and reliable immunometric point-of-care testing. Sci. Adv. 2022, 8, doi:10.1126/sciadv.abo0881. 18. Bhardwaj, V.; Kaushik, A. Biomedical applications of nanotechnology and nanomaterials. Micromachines 2017, 8, 298.
19. Medina Cruz, D.; Mostafavi, E.; Vernet-Crua, A.; Barabadi, H.; Shah, V.; Cholula-Díaz, J. L.; Guisbiers, G.; Webster, T. J. Green nanotechnology-based zinc oxide (ZnO) nanomaterials for biomedical applications: a review. J. Phys. Mater. 2020, 3, 34005, doi:10.1088/2515-7639/ab8186.
20. Cova, C. M.; Rincón, E.; Espinosa, E.; Serrano, L.; Zuliani, A. Paving the Way for a Green Transition in the Design of Sensors and Biosensors for the Detection of Volatile Organic Compounds (VOCs). Biosensors 2022, 12, 51, doi:10.3390/bios12020051.
21. Keirouz, A.; Mustafa, Y. L.; Turner, J. G.; Lay, E.; Jungwirth, U.; Marken, F.; Leese, H. S. Conductive Polymer-Coated 3D Printed Microneedles: Biocompatible Platforms for Minimally Invasive Biosensing Interfaces. Small 2023, doi:10.1002/smll.202206301.
22. Kukkar, D.; Zhang, D.; Jeon, B. H.; Kim, K. H. Recent advances in wearable biosensors for non-invasive monitoring of specific metabolites and electrolytes associated with chronic kidney disease: Performance evaluation and future challenges. TrAC - Trends Anal. Chem. 2022, 150.
23. Moreddu, R.; Elsherif, M.; Adams, H.; Moschou, D.; Cordeiro, M. F.; Wolffsohn, J. S.; Vigolo, D.; Butt, H.; Cooper, J. M.; Yetisen, A. K. Integration of paper microfluidic sensors into contact lenses for tear fluid analysis. Lab Chip 2020, 20, 3970–3979, doi:10.1039/d0lc00438c.
24. Nolan, J. K.; Nguyen, T. N. H.; Le, K. V. H.; DeLong, L. E.; Lee, H. Simple Fabrication of Flexible Biosensor Arrays Using Direct Writing for Multianalyte Measurement from Human Astrocytes. SLAS Technol. 2020, 25, 33–46, doi:10.1177/2472630319888442.
25. Gao, S.; Li, Q.; Zhang, S.; Sun, X.; Zhou, H.; Wang, Z.; Wu, J. A novel biosensing platform for detection of glaucoma biomarker GDF15 via an integrated BLI-ELASA strategy. Biomaterials 2023, 294, doi:10.1016/j.biomaterials.2023.121997.
26. Askarian, B.; Ho, P.; Chong, J. W. Detecting Cataract Using Smartphones. IEEE J. Transl. Eng. Heal. Med. 2021, 9, doi:10.1109/JTEHM.2021.3074597.
27. Vellappally, S.; Al Kheraif, A. A.; Anil, S.; Wahba, A. A. IoT medical tooth mounted sensor for monitoring teeth and food level using bacterial optimization along with adaptive deep learning neural network. Meas. J. Int. Meas. Confed. 2019, 135, 672–677, doi:10.1016/j.measurement.2018.11.078.
28. Arakawa, T.; Tomoto, K.; Nitta, H.; Toma, K.; Takeuchi, S.; Sekita, T.; Minakuchi, S.; Mitsubayashi, K. A Wearable Cellulose Acetate-Coated Mouthguard Biosensor for in Vivo Salivary Glucose Measurement. Anal. Chem. 2020, 92, 12201–12207, doi:10.1021/acs.analchem.0c01201.
29. Li, Y.; Hu, S.; Chen, C.; Alifu, N.; Zhang, X.; Du, J.; Li, C.; Xu, L.; Wang, L.; Dong, B. Opal photonic crystal-enhanced upconversion turn-off fluorescent immunoassay for salivary CEA with oral cancer. Talanta 2023, 124435, doi:10.1016/j.talanta.2023.124435.
30. Su, H.; Sun, F.; Lu, Z.; Zhang, J.; Zhang, W.; Liu, J. A wearable sensing system based on smartphone and diaper to detect urine in-situ for patients with urinary incontinence. Sensors Actuators B Chem. 2022, 357, doi:10.1016/j.snb.2022.131459.
31. Kim, H.; Park, S.; Jeong, I. G.; Song, S. H.; Jeong, Y.; Kim, C. S.; Lee, K. H. Noninvasive Precision Screening of Prostate Cancer by Urinary Multimarker Sensor and Artificial Intelligence Analysis. ACS Nano 2021, 15, 4054–4065, doi:10.1021/acsnano.0c06946.
32. Lei, Y.; Zhao, W.; Zhang, Y.; Jiang, Q.; He, J. H.; Baeumner, A. J.; Wolfbeis, O. S.; Wang, Z. L.; Salama, K. N.; Alshareef, H. N. A MXene-Based Wearable Biosensor System for High-Performance In Vitro Perspiration Analysis. Small 2019, 15, 1–10, doi:10.1002/smll.201901190.
33. Lee, S. P.; Ha, G.; Wright, D. E.; Ma, Y.; Sen-Gupta, E.; Haubrich, N. R.; Branche, P. C.; Li, W.; Huppert, G. L.; Johnson, M.; Mutlu, H. B.; Li, K.; Sheth, N.; Wright, J. A.; Huang, Y.; Mansour, M.; Rogers, J. A.; Ghaffari, R. Highly flexible, wearable, and disposable cardiac biosensors for remote and ambulatory monitoring. npj Digit. Med. 2018, 1, doi:10.1038/s41746-017-0009-x.
34. Dou, W.; Daoud, A.; Chen, X.; Wang, T.; Malhi, M.; Gong, Z.; Mirshafiei, F.; Zhu, M.; Shan, G.; Huang, X.; Maynes, J. T.; Sun, Y. Ultrathin and Flexible Bioelectronic Arrays for Functional Measurement of iPSC-Cardiomyocytes under Cardiotropic Drug Administration and Controlled Microenvironments. Nano Lett. 2023, doi:10.1021/acs.nanolett.3c00017.
35. Kim, T.; Park, I. Skin-interfaced Wearable Biosensors: A Mini-Review. J. Sens. Sci. Technol. 2022, 31, 71–78, doi:10.46670/jsst.2022.31.2.71.
36. Zeng, X.; Peng, R.; Fan, Z.; Lin, Y. Self-powered and wearable biosensors for healthcare. Mater. Today Energy 2022, 23.
37. Xia, H. qi; Tang, H.; Zhou, B.; Li, Y.; Zhang, X.; Shi, Z.; Deng, L.; Song, R.; Li, L.; Zhang, Z.; Zhou, J. Mediator-free electron-transfer on patternable hierarchical meso/macro porous bienzyme interface for highly-sensitive sweat glucose and surface electromyography monitoring. Sensors Actuators, B Chem. 2020, 312, doi:10.1016/j.snb.2020.127962.
38. Chidambaram, S.; Maheswaran, Y.; Patel, K.; Sounderajah, V.; Hashimoto, D. A.; Seastedt, K. P.; McGregor, A. H.; Markar, S. R.; Darzi, A. Using Artificial Intelligence-Enhanced Sensing and Wearable Technology in Sports Medicine and Performance Optimisation. Sensors 2022, 22.
39. Zhu, Y.; Haghniaz, R.; Hartel, M. C.; Guan, S.; Bahari, J.; Li, Z.; Baidya, A.; Cao, K.; Gao, X.; Li, J.; Wu, Z.; Cheng, X.; Li, B.; Emaminejad, S.; Weiss, P. S.; Khademhosseini, A. A Breathable, Passive-Cooling, Non-Inflammatory, and Biodegradable Aerogel Electronic Skin for Wearable Physical-Electrophysiological-Chemical Analysis. Adv. Mater. 2023, 35, doi:10.1002/adma.202209300.
40. Jin, X.; Li, G.; Xu, T.; Su, L.; Yan, D.; Zhang, X. Fully integrated flexible biosensor for wearable continuous glucose monitoring. Biosens. Bioelectron. 2022, 196, doi:10.1016/j.bios.2021.113760.
41. Nguyen, P. Q.; Soenksen, L. R.; Donghia, N. M.; Angenent-Mari, N. M.; de Puig, H.; Huang, A.; Lee, R.; Slomovic, S.; Galbersanini, T.; Lansberry, G.; Sallum, H. M.; Zhao, E. M.; Niemi, J. B.; Collins, J. J. Wearable materials with embedded synthetic biology sensors for biomolecule detection. Nat. Biotechnol. 2021, 39, 1366–1374, doi:10.1038/s41587-021-00950-3.
42. Daniels, J.; Wadekar, S.; DeCubellis, K.; Jackson, G. W.; Chiu, A. S.; Pagneux, Q.; Saada, H.; Engelmann, I.; Ogiez, J.; Loze-Warot, D.; Boukherroub, R.; Szunerits, S. A mask-based diagnostic platform for point-of-care screening of Covid-19. Biosens. Bioelectron. 2021, 192, doi:10.1016/j.bios.2021.113486.
43. Wasilewski, T.; Gębicki, J.; Kamysz, W. Bioelectronic nose: Current status and perspectives. Biosens. Bioelectron. 2017, 87, 480–494, doi:10.1016/j.bios.2016.08.080.
44. Zazzo, L. Di; Magna, G.; Lucentini, M.; Stefanelli, M.; Paolesse, R.; Natale, C. Di Sensor-Embedded Face Masks for Detection of Volatiles in Breath : A Proof of Concept Study. 2021.
45. Wasilewski, T.; Brito, N. F.; Szulczyński, B.; Wojciechowski, M.; Buda, N.; Melo, A. C. A.; Kamysz, W.; Gębicki, J. Olfactory receptor-based biosensors as potential future tools in medical diagnosis. TrAC Trends Anal. Chem. 2022, 150, 116599, doi:10.1016/j.trac.2022.116599. 46. Rezazadeh, M.; Seidi, S.; Lid, M.; Pedersen-Bjergaard, S.; Yamini, Y. The modern role of smartphones in analytical chemistry. TrAC - Trends Anal. Chem. 2019, 118, 548–555, doi:10.1016/j.trac.2019.06.019.
47. Torous, J.; Rodriguez, J.; Powell, A. The new digital divide for digital biomarkers. Digit. Biomarkers 2017, 1, 87–91. 48. Firdaus, M. L.; Saputra, E.; Ginting, S. M.; Wyantuti, S.; Eddy, D. R.; Rahmidar, L.; Yuliarto, B. Smartphone-based digital image colorimetry for non-enzymatic detection of glucose using gold nanoparticles. Sens. Bio-Sensing Res. 2022, 35, doi:10.1016/j.sbsr.2022.100472. 49. Al-Kassawneh, M.; Sadiq, Z.; Jahanshahi-Anbuhi, S. Pullulan-stabilized gold nanoparticles tablet as a nanozyme sensor for point-of-care applications. Sens. Bio-Sensing Res. 2022, 38, doi:10.1016/j.sbsr.2022.100526.
50. Jeon, H. J.; Kim, H. S.; Chung, E.; Lee, D. Y. Nanozyme-based colorimetric biosensor with a systemic quantification algorithm for noninvasive glucose monitoring. Theranostics 2022, 12, 6308–6338.
51. Olivier, M.; Asmis, R.; Hawkins, G. A.; Howard, T. D.; Cox, L. A. The Need for Multi-Omics Biomarker Signatures in Precision Medicine. Int. J. Mol. Sci. 2019, 20, 4781, doi:10.3390/ijms20194781.
52. Campuzano, S.; Barderas, R.; Yáñez-Sedeño, P.; Pingarrón, J. M. Electrochemical biosensing to assist multiomics analysis in precision medicine. Curr. Opin. Electrochem. 2021, 28.
53. Hollon, T. C.; Pandian, B.; Adapa, A. R.; Urias, E.; Save, A. V.; Khalsa, S. S. S.; Eichberg, D. G.; D’Amico, R. S.; Farooq, Z. U.; Lewis, S.; Petridis, P. D.; Marie, T.; Shah, A. H.; Garton, H. J. L.; Maher, C. O.; Heth, J. A.; McKean, E. L.; Sullivan, S. E.; Hervey-Jumper, S. L.; Patil, P. G.; Thompson, B. G.; Sagher, O.; McKhann, G. M.; Komotar, R. J.; Ivan, M. E.; Snuderl, M.; Otten, M. L.; Johnson, T. D.; Sisti, M. B.; Bruce, J. N.; Muraszko, K. M.; Trautman, J.; Freudiger, C. W.; Canoll, P.; Lee, H.; Camelo-Piragua, S.; Orringer, D. A. Near real-time intraoperative brain tumor diagnosis using stimulated Raman histology and deep neural networks. Nat. Med. 2020, 26, 52–58.
54. Boubin, M.; Shrestha, S. Microcontroller Implementation of Support Vector Machine for Detecting Blood Glucose Levels Using Breath Volatile Organic Compounds. Sensors (Basel). 2019, 19, doi:10.3390/s19102283.
55. Wang, H.; Zheng, B.; Yoon, S. W.; Ko, H. S. A support vector machine-based ensemble algorithm for breast cancer diagnosis. Eur. J. Oper. Res. 2018, 267, 687–699, doi:10.1016/j.ejor.2017.12.001.
56. Usama, M.; Qadir, J.; Raza, A.; Arif, H.; Yau, K. L. A.; Elkhatib, Y.; Hussain, A.; Al-Fuqaha, A. Unsupervised Machine Learning for Networking: Techniques, Applications and Research Challenges. IEEE Access 2019, 7, 65579–65615, doi:10.1109/ACCESS.2019.2916648.
57. Iii, K. E. S.; Yoon, J. Machine Learning Enhances the Performance of Bioreceptor- free Biosensors. 2021, 1–33.
58. Wang, J.; Xu, B.; Shi, L.; Zhu, L.; Wei, X. Prospects and Challenges of AI and Neural Network Algorithms in MEMS Microcantilever Biosensors. Processes 2022, 10.
59. Zhang, Y.; Hu, Y.; Jiang, N.; Yetisen, A. K. Wearable artificial intelligence biosensor networks. Biosens. Bioelectron. 2023, 219.
60. Cui, F.; Yue, Y.; Zhang, Y.; Zhang, Z.; Zhou, H. S. Advancing Biosensors with Machine Learning. ACS Sensors 2020, 5, 3346–3364.
61. Jin, X.; Cai, A.; Xu, T.; Zhang, X. Artificial intelligence biosensors for continuous glucose monitoring. Interdiscip. Mater. 2023, doi:10.1002/idm2.12069.
62. Stranieri, A.; Venkatraman, S.; Minicz, J.; Zarnegar, A.; Firmin, S.; Balasubramanian, V.; Jelinek, H. F. Emerging point of care devices and artificial intelligence: Prospects and challenges for public health. Smart Heal. 2022, 24, doi:10.1016/j.smhl.2022.100279.
63. Sempionatto, J. R.; Lin, M.; Yin, L.; De la paz, E.; Pei, K.; Sonsa-ard, T.; de Loyola Silva, A. N.; Khorshed, A. A.; Zhang, F.; Tostado, N.; Xu, S.; Wang, J. An epidermal patch for the simultaneous monitoring of haemodynamic and metabolic biomarkers. Nat. Biomed. Eng. 2021, 5, 737–748, doi:10.1038/s41551-021-00685-1.





