Adam Wójcik , Paweł Figaszewski
P.P.F. Hasco-Lek S.A.
strony wersji drukowanej: 42-44

strony wersji drukowanej: 42-44

Wyznaczanie masy w laboratorium fizycznym lub chemicznym, obok pomiaru objętości, jest najczęściej wykorzystywanym pomiarem i stanowi podstawę do dalszych analiz.
 Wagi różnego typu i klasy są podstawowym wyposażeniem każdego laboratorium, bez którego zdecydowana większość oznaczeń nie może być wykonana. Dotyczy to w równym stopniu dużych, przemysłowych laboratoriów farmaceutycznych czy chemicznych, ale też mniejszych jednostek jak np.: laboratoria geologiczne, środowiskowe czy medyczne.
Wagi różnego typu i klasy są podstawowym wyposażeniem każdego laboratorium, bez którego zdecydowana większość oznaczeń nie może być wykonana. Dotyczy to w równym stopniu dużych, przemysłowych laboratoriów farmaceutycznych czy chemicznych, ale też mniejszych jednostek jak np.: laboratoria geologiczne, środowiskowe czy medyczne.Wydawać by się mogło, że tak powszechnie wykorzystywany pomiar jest całkowicie i jednoznacznie zdefiniowany oraz, że nie powinien stwarzać żadnych problemów, nawet dla mniej wykwalifikowanych laborantów, a w pewnym zakresie nawet dla uczniów liceum. Tymczasem pomiar masy, wbrew pozorom, stanowi duże wyzwanie nawet dla najbardziej doświadczonego personelu i jest jednym z największych źródeł wprowadzania niepewności do całego procesu analizy próbki. Należy pamiętać, że od zważenia próbki najczęściej zaczyna się cały proces analityczny, więc błędy popełnione na tym etapie będą propagowane, a bardzo często multiplikowane, w kolejnych krokach przygotowania i analizy próby.
Zanim jednak zajmiemy się problematyką prawidłowego prowadzenia procesu ważenia należy zacząć od przykrego stwierdzenia, że jedna z najczęściej mierzonych wielkości fizycznych ma najgorzej zdefiniowaną jednostkę w układzie SI – zresztą nie lepiej jest w innych układach miar.
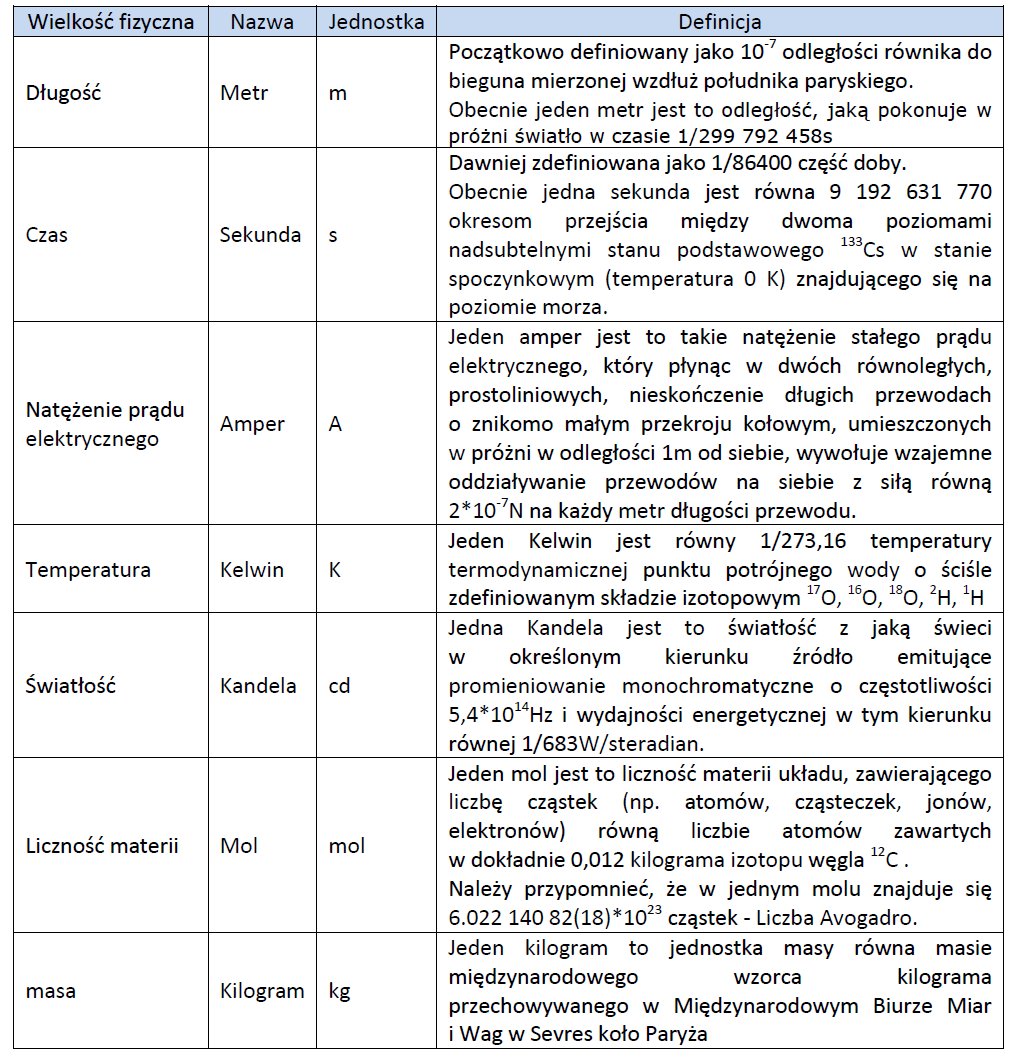
W tabeli 1 przedstawiono 7 podstawowych jednostek miar w układzie SI.
Tabela 1. Siedem podstawowych jednostek w układzie SI wraz z definicjami [1]
Pytanie brzmi „Która z poniższych jednostek nie pasuje do pozostałych?”
Odpowiedź na postawione pytanie jest oczywista i nie powinna stanowić problemu nawet początkującego fizyka czy chemika.
Wszystkie wielkości fizyczne, za wyjątkiem jednostki masy, są zdefiniowane jednoznacznie w sposób uniwersalny, bazujący na niezmiennych zjawiskach fizycznych. W praktyce można je odtworzyć w dowolnym miejscu i czasie. Problematyczna do odtworzenia może być jednostka światłości, jednak dla kilku wprawnych fizyków zbudowanie układu pomiarowego do odtworzenia Kandeli nie powinno stanowić problemu.
Spróbujmy jednak w jakimkolwiek laboratorium zbudować wzorzec kilograma, bez dostępu do wzorca podstawowego.
Teoretycznie jest to możliwe, ponieważ pierwowzór został zdefiniowany jako walec o średnicy 39 mm i wysokości 39 mm wykonany ze stopu 90% Platyny i 10% Irydu. Jednak podczas przechowywania, ale przede wszystkim podczas okresowego wzorcowania „klonów” i Wzorców Narodowych, co wiąże się z czyszczeniem i przenoszeniem, ubyło wzorca kilograma. Operacja wzorcowania względem wzorca podstawowego była wykonana dotychczas tylko 3-krotnie, jednak już stwierdzono ubytek wzorca głównego w stosunku do „klonów” o ok. 0,2 – 0,5 μg/rok.
Warto przypomnieć, że pierwsza definicja kilograma powstała jeszcze za czasów Ludwika XVI w roku 1791. Wówczas - „1 kg = masa 1 dm3 wody destylowanej w temperaturze 4°C przy ciśnieniu normalnym”. Ponieważ podstawą była masa objętości wody przy największej jej gęstości, postęp nauk ścisłych spowodował modyfikację definicji w zakresie temperatury: „(…)w temperaturze 3,95°C(...)”. Powyższa definicja obowiązywała w niektórych krajach aż do 1964 roku (!).
W Polsce bardzo długo, bo aż do lat powojennych, w wielu dziedzinach związanych z pomiarem masy, a w szczególności w handlu, obowiązywały ustalenia regionalne lub zwyczajowe. Bardzo mocno zakorzenioną jednostką był Funt (ok. 45 dag), który był zdefiniowany według poniższego schematu:
Berkowiec - 10 pudów
Pud - 40 funtów
Funt - 32 łuty
Łut -3 złotniki
Złotnik - 96 doli
Polski Urząd Miar zakupił Wzorzec Narodowy dopiero w 1952 roku (!), za równowartość około 100 średnich miesięcznych pensji. Dopiero od tego momentu rozpoczął się prawny metrologiczny nadzór nad pomiarami masy w Kraju nad Wisłą.
Nasz kraj nie jest jednak aż tak bardzo zacofany w kwestii metrologicznej jak można wnioskować na podstawie powyższego opisu. Przykładem niech będzie funt anglosaski (lb) tj.: 1 lb = masa 7000 ziaren pszenicy. Postęp agrotechniczny zwiększający średnią masę ziarna powodował, że funt wzrastał z roku na rok. Dopiero w 1958 roku określono ostateczną definicję:
1 lb = 0,45359237kg. Zauważmy, że podstawą stał się kilogram.
Od kilkudziesięciu lat trwają prace nad stworzeniem nowej definicji wzorca kilograma. Najbardziej obiecujący jest pomysł zdefiniowania kilograma wobec monokryształu krzemu. Jest to tzw. „Avogadro Project”. Jeśli wszystkie badania nad stworzeniem takiego kryształu, ale przede wszystkim nad określeniem ilości atomów budujących podstawową strukturę, zakończą się powodzeniem wtedy nowa definicja jednostki masy może przyjąć postać:
1kg = 1000/12*Liczba Avogadro atomów 12C, czyli: 5,01845075*1025 niezwiązanych, pozostających w spoczynku atomów 12C w stanie podstawowym [2].
Ciągły rozwój nauk ścisłych, a w szczególności eksperymentalnych, nie pozwala na żadne „wieloznaczności”. Kilogram jest podstawą definicji większości jednostek fizycznych, a większość opisanych obecnie zjawisk jako podstawę opisu przyjmują masę. Konsekwencje zmiany są trudne do przewidzenia, zważywszy, że obok „Avogadro Project” prowadzone są badania nad definicją masy poprzez zjawiska fizyczne lub chemiczne. Można być jednak pewnym, że jednoznaczne i ściśle zdefinio- wane określenie definicji jednostki masy jest nieuchronne.
W kolejnej części postaramy się przedstawić jak prawidłowo zmierzyć tą „niejednoznaczną” jednostkę w rutynowej pracy laboratoryjnej.
Przypisy:
[1] www.bipm.org
[2] J. Gluza, A. Grzanka, A. Pleban: „ Ku nowej definicji kilograma”, Postępy Fizyki, 2007, Tom 58, Zeszyt 3.
Zanim jednak zajmiemy się problematyką prawidłowego prowadzenia procesu ważenia należy zacząć od przykrego stwierdzenia, że jedna z najczęściej mierzonych wielkości fizycznych ma najgorzej zdefiniowaną jednostkę w układzie SI – zresztą nie lepiej jest w innych układach miar.
W tabeli 1 przedstawiono 7 podstawowych jednostek miar w układzie SI.
Tabela 1. Siedem podstawowych jednostek w układzie SI wraz z definicjami [1]

Pytanie brzmi „Która z poniższych jednostek nie pasuje do pozostałych?”
Odpowiedź na postawione pytanie jest oczywista i nie powinna stanowić problemu nawet początkującego fizyka czy chemika.
Wszystkie wielkości fizyczne, za wyjątkiem jednostki masy, są zdefiniowane jednoznacznie w sposób uniwersalny, bazujący na niezmiennych zjawiskach fizycznych. W praktyce można je odtworzyć w dowolnym miejscu i czasie. Problematyczna do odtworzenia może być jednostka światłości, jednak dla kilku wprawnych fizyków zbudowanie układu pomiarowego do odtworzenia Kandeli nie powinno stanowić problemu.
Spróbujmy jednak w jakimkolwiek laboratorium zbudować wzorzec kilograma, bez dostępu do wzorca podstawowego.
Teoretycznie jest to możliwe, ponieważ pierwowzór został zdefiniowany jako walec o średnicy 39 mm i wysokości 39 mm wykonany ze stopu 90% Platyny i 10% Irydu. Jednak podczas przechowywania, ale przede wszystkim podczas okresowego wzorcowania „klonów” i Wzorców Narodowych, co wiąże się z czyszczeniem i przenoszeniem, ubyło wzorca kilograma. Operacja wzorcowania względem wzorca podstawowego była wykonana dotychczas tylko 3-krotnie, jednak już stwierdzono ubytek wzorca głównego w stosunku do „klonów” o ok. 0,2 – 0,5 μg/rok.
Warto przypomnieć, że pierwsza definicja kilograma powstała jeszcze za czasów Ludwika XVI w roku 1791. Wówczas - „1 kg = masa 1 dm3 wody destylowanej w temperaturze 4°C przy ciśnieniu normalnym”. Ponieważ podstawą była masa objętości wody przy największej jej gęstości, postęp nauk ścisłych spowodował modyfikację definicji w zakresie temperatury: „(…)w temperaturze 3,95°C(...)”. Powyższa definicja obowiązywała w niektórych krajach aż do 1964 roku (!).
W Polsce bardzo długo, bo aż do lat powojennych, w wielu dziedzinach związanych z pomiarem masy, a w szczególności w handlu, obowiązywały ustalenia regionalne lub zwyczajowe. Bardzo mocno zakorzenioną jednostką był Funt (ok. 45 dag), który był zdefiniowany według poniższego schematu:
Berkowiec - 10 pudów
Pud - 40 funtów
Funt - 32 łuty
Łut -3 złotniki
Złotnik - 96 doli
Polski Urząd Miar zakupił Wzorzec Narodowy dopiero w 1952 roku (!), za równowartość około 100 średnich miesięcznych pensji. Dopiero od tego momentu rozpoczął się prawny metrologiczny nadzór nad pomiarami masy w Kraju nad Wisłą.
Nasz kraj nie jest jednak aż tak bardzo zacofany w kwestii metrologicznej jak można wnioskować na podstawie powyższego opisu. Przykładem niech będzie funt anglosaski (lb) tj.: 1 lb = masa 7000 ziaren pszenicy. Postęp agrotechniczny zwiększający średnią masę ziarna powodował, że funt wzrastał z roku na rok. Dopiero w 1958 roku określono ostateczną definicję:
1 lb = 0,45359237kg. Zauważmy, że podstawą stał się kilogram.
Od kilkudziesięciu lat trwają prace nad stworzeniem nowej definicji wzorca kilograma. Najbardziej obiecujący jest pomysł zdefiniowania kilograma wobec monokryształu krzemu. Jest to tzw. „Avogadro Project”. Jeśli wszystkie badania nad stworzeniem takiego kryształu, ale przede wszystkim nad określeniem ilości atomów budujących podstawową strukturę, zakończą się powodzeniem wtedy nowa definicja jednostki masy może przyjąć postać:
1kg = 1000/12*Liczba Avogadro atomów 12C, czyli: 5,01845075*1025 niezwiązanych, pozostających w spoczynku atomów 12C w stanie podstawowym [2].
Ciągły rozwój nauk ścisłych, a w szczególności eksperymentalnych, nie pozwala na żadne „wieloznaczności”. Kilogram jest podstawą definicji większości jednostek fizycznych, a większość opisanych obecnie zjawisk jako podstawę opisu przyjmują masę. Konsekwencje zmiany są trudne do przewidzenia, zważywszy, że obok „Avogadro Project” prowadzone są badania nad definicją masy poprzez zjawiska fizyczne lub chemiczne. Można być jednak pewnym, że jednoznaczne i ściśle zdefinio- wane określenie definicji jednostki masy jest nieuchronne.
W kolejnej części postaramy się przedstawić jak prawidłowo zmierzyć tą „niejednoznaczną” jednostkę w rutynowej pracy laboratoryjnej.
Przypisy:
[1] www.bipm.org
[2] J. Gluza, A. Grzanka, A. Pleban: „ Ku nowej definicji kilograma”, Postępy Fizyki, 2007, Tom 58, Zeszyt 3.





